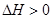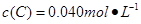题目内容
(10分)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2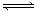 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
(1)1100C时平衡常数:
(2)实验1中,CCl4的转化率A为:
(3)实验2中,10小时后达到平衡,H2的平均反应速率为: 。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向 反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值
①等于50% ②大于50% ③小于50% ④无法判断
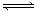 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)| 实验序号 | 温度0C | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(2)实验1中,CCl4的转化率A为:
(3)实验2中,10小时后达到平衡,H2的平均反应速率为: 。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向 反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值
①等于50% ②大于50% ③小于50% ④无法判断
(每空2分,共10分)(1)1;(2)60%;(3)0.05mol /(L?h)、正;(4)④
(1)根据表中数据可知,110℃平衡时生成物的浓度都是0.5mol/L,而反应物的浓度也都是0.5mol/L,所以该温度下的平衡常数为 。
。
(2)设转化率是x,则生成物CHCl3、 HCl都是0.8xmol/L,消耗氢气也是0.8xmol/L,所以剩余CCl4和氢气分别是(0.8-0.8x)mol/L、(1.2-0.8x)mol/L.因此根据平衡常数表达式可知 ,解得x=0.6,即转化率是60%。
,解得x=0.6,即转化率是60%。
(3)消耗氢气是0.5mol/L,所以氢气反应速率是0.5mol/L÷10h=0.05mol /(L?h)。在加入的瞬间有 <1,所以反应向正反应方向移动。
<1,所以反应向正反应方向移动。
(4)由于反应是放热反应还是吸热反应无法确定,因此无法判断平衡移动方向,答案选④。
 。
。(2)设转化率是x,则生成物CHCl3、 HCl都是0.8xmol/L,消耗氢气也是0.8xmol/L,所以剩余CCl4和氢气分别是(0.8-0.8x)mol/L、(1.2-0.8x)mol/L.因此根据平衡常数表达式可知
 ,解得x=0.6,即转化率是60%。
,解得x=0.6,即转化率是60%。(3)消耗氢气是0.5mol/L,所以氢气反应速率是0.5mol/L÷10h=0.05mol /(L?h)。在加入的瞬间有
 <1,所以反应向正反应方向移动。
<1,所以反应向正反应方向移动。(4)由于反应是放热反应还是吸热反应无法确定,因此无法判断平衡移动方向,答案选④。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )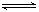 2C(g),若经2秒后测得C的浓度为0.6 mo1·L-1,现有下列几种说法:
2C(g),若经2秒后测得C的浓度为0.6 mo1·L-1,现有下列几种说法: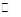 2C(g),现等物质的量的投料反应物A、B于恒温恒容体系I和恒温、恒压体系II中,达平衡时体系I中A的物质的量浓度为M,体系II中A的物质的量浓度为m,则M与m的关系为
2C(g),现等物质的量的投料反应物A、B于恒温恒容体系I和恒温、恒压体系II中,达平衡时体系I中A的物质的量浓度为M,体系II中A的物质的量浓度为m,则M与m的关系为 C(g)
C(g) 2NH3
2NH3 2C(g) △H>0,达到平衡后,将反应混合物温度降低,下列叙述中,正确的
2C(g) △H>0,达到平衡后,将反应混合物温度降低,下列叙述中,正确的
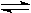 2M
2M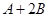
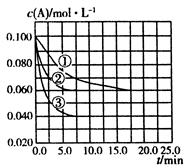
 C分别在三种不同实验条件下进行,它们的起始状态均为
C分别在三种不同实验条件下进行,它们的起始状态均为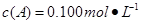 、
、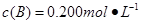 、
、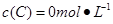 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是