题目内容
(16分)(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: Pt极______ _ ;当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________________;
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,负极电极反应式为:
随着放电的进行,溶液的pH (填“变大”“变小”或“不变”)
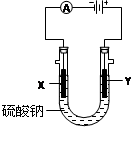
(Ⅲ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以______为阳极电解________ 溶液,阳极电极反应式为____________________________ 。
(2)以铂作阳极电解 ________ 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 __________________________ 。
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: Pt极______ _ ;当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________________;
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,负极电极反应式为:
随着放电的进行,溶液的pH (填“变大”“变小”或“不变”)
(Ⅲ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以______为阳极电解________ 溶液,阳极电极反应式为____________________________ 。
(2)以铂作阳极电解 ________ 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 __________________________ 。
(Ⅰ)(1)原电池 (1分) (2)2Cl-- 2e-= Cl2↑(2分) 6.4g (2分)
(3)无变化(1分)
(Ⅱ)CH4+10OH--8e=CO32-+7H2O (2分) 变小(1分)
(Ⅲ)(1) 铂(1分) Na2SO4(1分)
4OH--4e- = 2H2O+O2↑(2分)(写2H2O-4e- = O2↑+4H+ 同样给分)
(2) NaCl(1分) 2NaCl+2H2O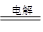 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(没写“电解”或“通电”不给分)
(3)无变化(1分)
(Ⅱ)CH4+10OH--8e=CO32-+7H2O (2分) 变小(1分)
(Ⅲ)(1) 铂(1分) Na2SO4(1分)
4OH--4e- = 2H2O+O2↑(2分)(写2H2O-4e- = O2↑+4H+ 同样给分)
(2) NaCl(1分) 2NaCl+2H2O
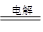 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)(没写“电解”或“通电”不给分)
(Ⅰ)(1)甲装置轴锌和稀硫酸可以发生置换反应,所以甲是原电池,乙是电解池。
(2)锌比铜活泼,所以锌是负极,铜是正极,则Pt是阳极,溶液中的氯离子在阳极失去电子,生成氯气,反应式为2Cl-- 2e-= Cl2↑。甲中产生的气体是氢气,物质的量是0.1mol,转移电子是0.2mol,所以根据电子的得失守恒可知,乙中析出铜的物质的量是0.2mol÷2=0.1mol,其质量为6.4g。
(3)都换成铜电极,则阳极铜失去电子,同时阴极铜离子又得到电子而析出,所以溶液的浓度是不变的,即溶液的颜色无变化。
(Ⅱ)甲烷在反应中失去电子,所以在负极通入。又因为溶液显碱性,所以负极电极反应式为CH4+10OH--8e-=CO32-+7H2O。氧气得到电子,在正极通入,电极反应式为2O2+8e-+4H2O=8OH-,所以总反应式为CH4+2O2+2OH-=CO32-+3H2O,所以溶液的pH是减小的。
(Ⅲ)(1) )要使电解过程中溶质的组成和质量不变,则电解的是水,所以电解的是硫酸钠。阳极是OH-放电,反应式为4OH--4e- = 2H2O+O2↑。
(2)溶液的碱性有明显增强,且溶液保澄清,所以电解的是氯化钠溶液,反应式为
2NaCl+2H2O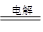 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)锌比铜活泼,所以锌是负极,铜是正极,则Pt是阳极,溶液中的氯离子在阳极失去电子,生成氯气,反应式为2Cl-- 2e-= Cl2↑。甲中产生的气体是氢气,物质的量是0.1mol,转移电子是0.2mol,所以根据电子的得失守恒可知,乙中析出铜的物质的量是0.2mol÷2=0.1mol,其质量为6.4g。
(3)都换成铜电极,则阳极铜失去电子,同时阴极铜离子又得到电子而析出,所以溶液的浓度是不变的,即溶液的颜色无变化。
(Ⅱ)甲烷在反应中失去电子,所以在负极通入。又因为溶液显碱性,所以负极电极反应式为CH4+10OH--8e-=CO32-+7H2O。氧气得到电子,在正极通入,电极反应式为2O2+8e-+4H2O=8OH-,所以总反应式为CH4+2O2+2OH-=CO32-+3H2O,所以溶液的pH是减小的。
(Ⅲ)(1) )要使电解过程中溶质的组成和质量不变,则电解的是水,所以电解的是硫酸钠。阳极是OH-放电,反应式为4OH--4e- = 2H2O+O2↑。
(2)溶液的碱性有明显增强,且溶液保澄清,所以电解的是氯化钠溶液,反应式为
2NaCl+2H2O
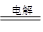 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2Ni(OH)2 。根据此反应判断,下列叙述中不正确的是( )
2Ni(OH)2 。根据此反应判断,下列叙述中不正确的是( )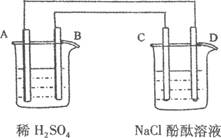

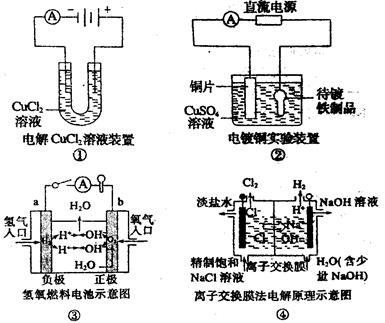
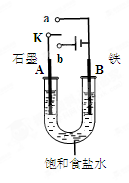
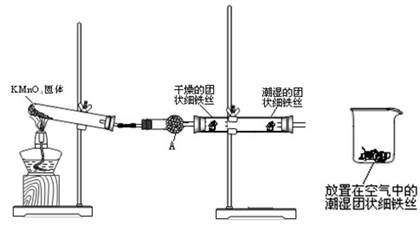

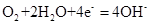
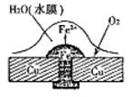
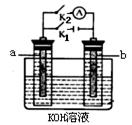
 (2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为 ,OH-向 (填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为 ,OH-向 (填a或b)极移动。
(2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为 ,OH-向 (填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为 ,OH-向 (填a或b)极移动。