题目内容
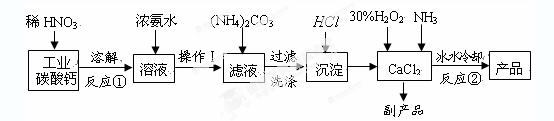
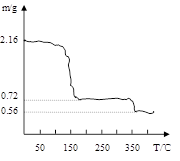
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。

已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题。
(1)E、H的化学式依次为 、 。
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为 。
(3)加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuCl2·3H2O,需要经过蒸发浓缩、 、过滤、洗涤、干燥等操作,洗涤CuCl2·3H2O晶体需要的主要玻璃仪器有烧杯、 。

已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)E、H的化学式依次为 、 。
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为 。
(3)加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuCl2·3H2O,需要经过蒸发浓缩、 、过滤、洗涤、干燥等操作,洗涤CuCl2·3H2O晶体需要的主要玻璃仪器有烧杯、 。
(1)(1)CO2 NH4Cl(2)Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀。所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+。 (3)3.2<pH<4.7(4)冷却结晶玻璃棒、漏斗(漏写扣1分)除标示外,其余每空2分
试题分析:(1)孔雀石的成份是碱式碳酸铜,与酸反应生成二氧化碳气体,故E、H的化学式依次为CO2 NH4Cl。(2)根据表中数据Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀。所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+,便于后续沉淀除去。 (3)加入CuO的作用是调节溶液pH,要保证铜离子不要沉淀,三价铁离子尽可能完全沉淀,根据表中的数据则pH的范围为3.2<pH<4.7。(4)由溶液C获得CuCl2·3H2O,需要经过蒸发浓缩、冷却结晶玻璃棒、过滤、洗涤、干燥等操作,洗涤CuCl2·3H2O晶体需要的主要玻璃仪器有烧杯、漏斗。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 无沉淀
无沉淀 白色沉淀
白色沉淀 无明显现象
无明显现象 红色溶液
红色溶液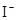 :试液
:试液 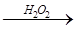 棕黄色溶液
棕黄色溶液 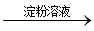 蓝色溶液
蓝色溶液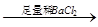 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解