题目内容
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验.请回答下列问题: 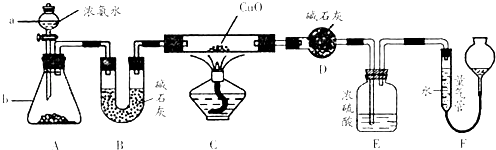
(1)仪器a的名称为;仪器b中可选择的试剂为 .
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母).
A.Cl2
B.O2
C.CO2
D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有性,写出相应的化学方程式
(4)E装置中浓硫酸的作用 .
(5)读取气体体积前,应对装置F进行的操作:
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n字母的代数式表示)
【答案】
(1)分液漏斗;氢氧化钠固体或氧化钙固体或碱石灰
(2)BC
(3)还原;3CuO+2NH3![]() 3Cu+3H2O+N2
3Cu+3H2O+N2
(4)吸收未反应的氨气,阻止F中水蒸气进入D
(5)慢慢上下移动右边漏斗,使左右两管液面相平
(6)![]()
【解析】解:(1)装置中仪器a为分液漏斗;仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体,
所以答案是:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;(2)利用装置A,可制取的无色气体;
A.制备氯气Cl2需要加热,且氯气为黄绿色气体,故A不符合;
B.可以制备O2,利用固体过氧化钠和水的反应,故B符合;
C.可以制备CO2 气体,利用稀盐酸滴入大理石上反应生成,故C符合;
D.NO2是红棕色气体,故D不符合;
故选BC;(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为:3CuO+2NH3 ![]() 3Cu+3H2O+N2 ,所以答案是:还原;3CuO+2NH3
3Cu+3H2O+N2 ,所以答案是:还原;3CuO+2NH3 ![]() 3Cu+3H2O+N2 ;(4)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,所以答案是:吸收未反应的氨气,阻止F中水蒸气进入D;(5)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数,所以答案是:慢慢上下移动右边漏斗,使左右两管液面相平;(6)若测得干燥管D增重mg为水物质的量=
3Cu+3H2O+N2 ;(4)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,所以答案是:吸收未反应的氨气,阻止F中水蒸气进入D;(5)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数,所以答案是:慢慢上下移动右边漏斗,使左右两管液面相平;(6)若测得干燥管D增重mg为水物质的量= ![]() ,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=
,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量= ![]() ,依据元素守恒得到氮原子和氢原子物质的量之比=
,依据元素守恒得到氮原子和氢原子物质的量之比= ![]() ×2:
×2: ![]() ×2=
×2= ![]() ,则氨分子中氮、氢的原子个数比为
,则氨分子中氮、氢的原子个数比为 ![]() ,所以答案是:
,所以答案是: ![]() .
.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1 )称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
(2 )将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2 )A的分子式为: . |
(3 )另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3 )该有机物分子中含有羟基、羧 |
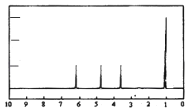
(4 )A的核磁共振氢谱如图: | (4 )A中含有种氢原子. |
(5 )综上所述,A的结构简式 , | |
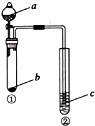
【题目】利用如图所示装置进行下列实验,试管②中一定观察不到的现象是( )
选项 | a | b | c | 试管②中现象 |
|
A | NaOH溶液 | Al | 肥皂水 | 肥皂泡可点燃 | |
B | 稀盐酸 | 碳酸钙 | NaAlO2溶液 | 生成白色絮状沉淀生成 | |
C | 稀硫酸 | NaHCO3 | BaCl2溶液 | 溶液变浑浊 | |
D | 水 | Na2O2 | 酸化的FeSO4溶液 | 溶液变黄 |
A.A
B.B
C.C
D.D