题目内容
【题目】在一恒温恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
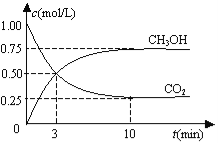
A.反应进行到3min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.第3min时,氢气的平均反应速率为1.5mol/(L·min)
D.该温度下,反应的平衡常数的值为![]()
【答案】D
【解析】
试题分析:A.3min时,物质的浓度仍在变化,未达到平衡状态,故A错误;B.开始充入1molCO2,而开始的CO2浓度为1mol/L,所以该密闭容器的体积为![]() =1L,平衡时生成甲醇为0.75mol/L×1L=0.75mol,则参加反应二氧化碳为0.75mol=0.75mol,故二氧化碳转化率为
=1L,平衡时生成甲醇为0.75mol/L×1L=0.75mol,则参加反应二氧化碳为0.75mol=0.75mol,故二氧化碳转化率为![]() ×100%=75%,故B错误;C.第3min时,v(CH3OH)=
×100%=75%,故B错误;C.第3min时,v(CH3OH)=![]() =
=![]() molL-1min-1,速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=0.5molL-1min-1,故C错误;D.平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
molL-1min-1,速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=0.5molL-1min-1,故C错误;D.平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L):1300
变化浓度(mol/L):0.752.250.750.75
平衡浓度(mol/L):0.250.750.750.75
则平衡常数K=![]() =
=![]() =
=![]() ,故D正确,故选D。
,故D正确,故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目