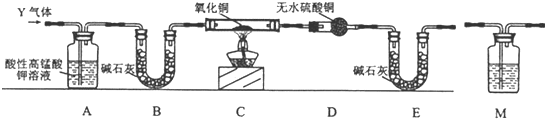
题目内容
10.向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)?2SO3 (g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)分别以单位时间内O2,SO3的物质的量浓度的改变量来表示该反应的反应速率;
(2)平衡时体系中 SO3的物质的量浓度.
分析 向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,经4s后达到平衡状态,测得SO2的物质的量是3mol,则:
2SO2(g)+O2(g)?2SO3 (g)
起始量(mol):7 4 0
变化量(mol):4 2 4
平衡量(mol):3 2 4
(1)根据v=$\frac{△c}{△t}$计算v(O2)、v(SO3);
(2)根据c=$\frac{n}{V}$计算平衡时体系中 SO3的物质的量浓度.
解答 解:向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,经4s后达到平衡状态,测得SO2的物质的量是3mol,则:
2SO2(g)+O2(g)?2SO3 (g)
起始量(mol):7 4 0
变化量(mol):4 2 4
平衡量(mol):3 2 4
(1)则v(O2)=$\frac{\frac{2mol}{4L}}{4s}$=0.125mol•L-1•s-1;
v(SO3)=$\frac{\frac{4mol}{4L}}{4s}$=0.25mol•L-1•s-1,
答:用氧气表示的平均反应速率为0.125mol•L-1•s-1,用三氧化硫表示的速率为0.25mol•L-1•s-1.
(2)平衡时体系中 SO3的物质的量浓度为$\frac{4mol}{4L}$=1mol/L,
答:平衡时体系中 SO3的物质的量浓度为1mol/L.
点评 本题考查化学平衡计算,比较基础,化学反应速率一般根据定义式及反应速率规律进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.有关胶体的说法正确的是( )
| A. | 胶体都带电荷,因而都有电泳现象 | |
| B. | 鉴别胶体和溶液可用渗析法 | |
| C. | 血清透析和制豆腐利用胶体的性质相同 | |
| D. | 胶体的胶粒直径在1nm~100nm之间 |
7.在标准状况下,ag气体A与bg气体B的分子数相同,下列说法中不正确的是( )
| A. | 两种气体A与B的相对分子质量之比为a:b | |
| B. | 同温同压下A、B两气体的密度之比为b:a | |
| C. | 同质量气体A与B的分子数之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
4.已知离子的氧化性:Fe3->SO${\;}_{4}^{2-}$,离子的还原性:S2->I->Fe2+,向FeCl3溶液中加入下列物质,溶液颜色不是因发生化学变化而改变的是( )
| A. | SO2 | B. | Na2S | C. | KI | D. | CuSO4 |
5.在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下:(2NO2(g)?N2O4(g)△H<0)
下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ)=2K(Ⅱ) | |
| C. | 平衡后,向两容器中分别再充入一定量的NO2,(Ⅰ)中$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})}$的值减小,(Ⅱ)$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})}$ 的值增大 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
2.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol乙酸分子的σ键有7NA | |
| B. | 11.2 L乙烯完全燃烧转移电子数为6.0NA | |
| C. | 88.0g 干冰中含有的电子对数为8.0NA | |
| D. | 1.2g 金刚石中含有的碳碳键数为0.4 NA |
19.符合如图阴影部分的物质是( )
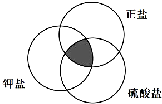

| A. | K2SO3 | B. | Na2SO4 | C. | K2SO4 | D. | KCl |