题目内容
15.工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:[探究一]
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是铁在冷的浓硫酸中钝化.
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y.
①甲同学认为X中可能含有Fe3+和Fe2+.若要确认其中的Fe2+,应选用b(填序号).
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为SO2+Br2+2H2O=SO42-+2Br-+4H+,充分反应后,加入足量BaCI2溶液,经适当操作后得干燥固体2.33g.可推知气体Y中S02的体积分数为50%.
[探究二]
据探究一所测S02的体积分数,丙同学认为气体Y中可能还含有C02和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究.
(3)装置A中的现象是溶液颜色变浅,其作用是除去SO2并检验SO2除尽.
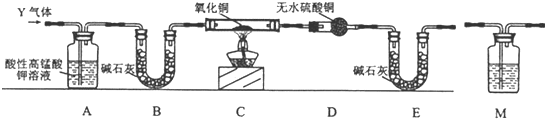
(4)为判断CO2是否存在,需将装置M添加在b.(填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为2:1.
(5)若C中固体变红,D中固体变蓝,则Q是H2 (填化学式),产生该气体的原因是随着反应进行,硫酸浓度变稀,铁与稀硫酸反应生成氢气.
(6)若某气体可能由C02、S02、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为ace(填序号).
a.SO2 b.H2、SO2 c.H2、CO2 d.CO2、SO2 e.SO2、CO2、H2.
分析 本题以探究铁与冷的浓硫酸发生钝化现象为载体,探究铁分别与冷的浓硫酸和热的浓硫酸反应原理,并检验产物中可能生成的Fe2+或可能出现的Fe3+,其中Fe2+的检验通常选用铁氰化钾溶液现象是生成蓝色沉淀,生成的SO2气体能使溴水褪色,同时生成硫酸,因使用的铁中含有碳,能被浓硫酸氧化,同时硫酸浓度变稀后,还可能有氢气生成,因此得到的SO2中可能含有二氧化碳和氢气,为验证其成分,进行了实验探究,首先结合SO2的还原性,利用酸性高锰酸钾溶液除去SO2,将剩余气体干燥后通过灼热的氧化铜,发现氧化铜由黑色变为红色可知有氢气,石灰水变浑浊可知有CO2,不过前提是排除SO2的干扰,据此可作答;
(1)常温下,铁易和浓硫酸发生钝化现象,从而阻止进一步反应;
(2)①Fe3+常用KSCN溶液检验,Fe2+可利用铁氰化钾溶液检验;
②SO2有还原性,能使溴水褪色,生成硫酸,滴加氯化钡溶液生成硫酸钡沉淀,利用硫原子守恒可计算混合气体中SO2的体积分数;
(3)SO2有还原性,能使酸性高锰酸钾溶液褪色,利用A装置可吸收SO2;
(4)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰,合金中的碳与浓硫酸在加热条件下有CO2生成,同时得到还原产物SO2;
(5)若C中固体变红说明氧化铜发生了还原反应,D中硫酸铜固体变蓝说明C中有水生成,可结合讨论有氢气,产生氢气的可能原因是铁能与稀硫酸反应生成氢气;
(6)SO2中氧元素的含量为50%,CO2中氧元素的含量为73%,H2中不含氧元素,氧元素含量为0;
解答 解:(1)常温下,Fe易和浓硫酸发生氧化还原反应生成致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以放入浓硫酸后的碳素钢加入硫酸铜溶液中无变化,说明铁在冷的浓硫酸中钝化,故答案为:铁在冷的浓硫酸中钝化;
(2)①a.KSCN溶液遇Fe3+变血红色,遇Fe2+无现象,故错误;b.铁氰化钾溶液遇含有Fe2+有蓝色沉淀,故正确;c.盐酸只能抑制Fe2+的水解,无法鉴别,故错误;
故选b;
②气体Y通入足量溴水中发生反应,SO2+Br2+2H2O=2HBr+H2SO4,离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,SO42-+Ba2+=BaSO4所以硫酸钡和二氧化硫之间的关系式为SO2~BaSO4,设二氧化硫的体积为V,
SO2~~~~BaSO4,
V 2.33g
V=0.224L=224mL,所以二氧化硫的体积分数为$\frac{224mL}{448mL}$×100%=50%,故答案为:50%;
(3)SO2有还原性能被酸性KMnO4溶液氧化,故A中溶液紫色变浅,利用此装置可吸收SO2气体并根据紫色没有完全褪去,判断SO2已除尽,故答案为:溶液颜色变浅;除去SO2并检验SO2除尽;
(4)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以要检验二氧化碳必须排除二氧化硫的干扰,A装置是吸收SO2并检验二氧化硫是否除尽,另外气体需干燥后才可以通过加热的玻璃管,所以为不影响后续实验操作,澄清石灰水应放置在A和B之间,二氧化碳是碳与浓硫酸反应生成的,发生反应的化学方程式为C+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O,此反应中碳为还原剂,硫酸为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故答案为:b;2:1;
(5)C中氧化铜被还原,D中检验有水生成,可知气体中有氢气,可能是浓硫酸随反应的进行浓度变稀,铁与稀硫酸反应生成氢气,故答案为:H2;随着反应进行,硫酸浓度变稀,铁与稀硫酸反应生成氢气;
(6)①现测知该气体中含氧质量分数为50%,而SO2中氧元素的质量分数正好为:50%,所以该气体有可能是纯净物SO2②CO2中氧元素的质量分数为72.7%比50%大,但如果和一定量的H2混合,总的氧元素的质量分数就会比72.7%小,可能达到50%,所以该气体有可能是CO2和H2的混合物;③还有可能是三者的混合物,因为SO2中氧元素的质量分数正好为:50%与该气体中氧元素的质量分数相同,对总的含氧量不影响;而CO2和H2混合,氧元素的质量分数比72.7%小,可能达到50%,所以该气体有可能是SO2、H2、CO2的混合物;④如果是SO2和H2混合;或单独是H2,氧元素的质量分数就会比50%小;如果是SO2和CO2混合;或单独是CO2氧元素的质量分数比72.7%大,所以都不符合,则有三种情况:(1)SO2:(2)CO2和H2的混合物;(3)SO2、H2、CO2的混合物满足,即选项ace正确,答案为:ace.
点评 本题以铁与浓硫酸钝化为载体,探究铁碳在热的浓硫酸中反应生成的溶液及气体混合物的成分鉴别,综合性比较强,但考查的均为基础性知识,难度不大.

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案| A. | S2-、I-、Br-、SO${\;}_{3}^{2-}$ | B. | S、I2、Br2、SO2 | ||
| C. | Fe2+、H+、NO${\;}_{3}^{-}$、MnO${\;}_{4}^{-}$ | D. | Fe3+、H+、Cu2+、Al3+ |
| A. | 2L SO2和2L CO2 | B. | 9g水和标准状况下11.2L CO2 | ||
| C. | 标准状况下1mol氧气和22.4L水 | D. | 0.2mol H2S和2.24L HCl |
 只有C是金属,D的单质是黄色固体.
只有C是金属,D的单质是黄色固体. .
.