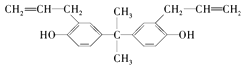
题目内容
【题目】已知:2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl(浓)2KCl+2CrCl3+3Cl2↑+7H2O, MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(大于6 molL-1)反应,MnO2需和浓盐酸(大于8 molL-1)反应。根据以上信息,下列结论中不正确的是
MnCl2+Cl2↑+2H2O,其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(大于6 molL-1)反应,MnO2需和浓盐酸(大于8 molL-1)反应。根据以上信息,下列结论中不正确的是
A. 上述反应都属于氧化还原反应 B. 生成1 mol Cl2转移电子数均为2NA
C. 盐酸浓度越大,Cl—的还原性越强 D. 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
【答案】D
【解析】A、上述反应中都存在HCl→Cl2的变化,有化合价的改变,属于氧化还原反应,故A正确;B、HCl中Cl元素化合价由-1价升高到0价,每生成1个Cl2,化合价升2,即转移2个电子,则生成1 mol Cl2转移电子数均为2NA,故B正确;C、MnO2与浓盐酸反应,而不与稀盐酸反应,说明浓盐酸还原性强,稀盐酸还原性弱,即盐酸浓度越大,Cl—的还原性越强,故C正确;D、根据各反应条件可知,氧化性KMnO4>K2Cr2O7>MnO2,根据氧化剂氧化性大于氧化产物,MnO2能将HCl氧化为Cl2,则说明MnO2氧化性强于Cl2,故D错误。故选D。

 名校课堂系列答案
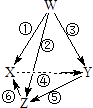
名校课堂系列答案【题目】下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是( )
选项 | W | X | Y | Z |
|
A | N2 | NH3 | NO | NO2 | |
B | Na | Na2O2 | NaOH | Na2CO3 | |
CC | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
A.A
B.B
C.C
D.D
【题目】三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+ ![]()
![]()
![]() +3H2O
+3H2O
物质 | 相对 | 密度/gcm﹣3 | 沸点/℃ | 水中 |
甘油 | 92 | 1.2636 | 290 | 溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
三乙酸甘油酯 | 218 | 1.1596 | 258 | 不溶 |

实验步骤:
步骤1.在500mL反应器中加入200g冰醋酸,92g甘油和100mL苯,开动搅拌器,慢慢从插温度计口加入3mL浓硫酸后,缓缓加热并回流1h,停止加热.
步骤2.用5%碳酸钠溶液洗涤,再用水洗涤,最后加入无水氯化钙.
步骤3.先进行常压蒸馏收集75~85℃馏分.
步骤4.将常压馏分再进行减压蒸馏,收集128~131℃/933Pa馏分,最终得产品176g.
(1)步骤1先开搅拌器后加浓硫酸的目的是;冰醋酸过量的目的是
(2)用5%碳酸钠溶液洗涤的主要目的是;加无水氯化钙的目的是
(3)最后用减压蒸馏而不用常压蒸馏其原因是
(4)本次实验产率为 .
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 | 1.5 mol A | 1.5 mol A | 6.0 mol A |
下列说法正确的是( )
A.平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大
B.达到平衡时反应吸收的热量:Q丙>2Q乙
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%