题目内容
【题目】![]() 是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
A. 可发生反应:![]()
B. 具有吸水性,需要密封保存
C. 能与![]() ,反应生成新盐
,反应生成新盐
D. 与足量盐酸作用,所得固体产物主要为![]()
【答案】D
【解析】
将Ca3SiO5改写为氧化物形式后的化学式为:3CaO·SiO2,性质也可与Na2SiO3相比较,据此解答。
A.Ca3SiO5与NH4Cl反应的方程式为:Ca3SiO5+4NH4Cl ![]() CaSiO3+2CaCl2+4NH3↑+2H2O,A正确;
CaSiO3+2CaCl2+4NH3↑+2H2O,A正确;
B.CaO能与水反应,所以需要密封保存,B正确;
C.亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca3SiO5溶液时,发生反应:3SO2+H2O+ Ca3SiO5=3 CaSO3+H2SiO3,C正确;
D.盐酸的酸性比硅酸强,当盐酸与Ca3SiO5反应时,发生反应:6HCl+ Ca3SiO5=3CaCl2+H2SiO3+2H2O,D不正确;
故选D。

【题目】动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究____________元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:①__________,②__________,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)__________
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①_____________________________________,
②_____________________________________,
此实验的结论:_______________________________________________________。
【题目】研究![]() 氧化
氧化![]() 制
制![]() 对资源综合利用有重要意义。相关的主要化学反应有:
对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ ![]()
![]()
Ⅱ ![]()
![]()
Ⅲ ![]()
![]()
Ⅳ ![]()
![]()
已知:![]() 时,相关物质的相对能量(如图1)。
时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的![]() (
(![]() 随温度变化可忽略)。例如:
随温度变化可忽略)。例如: ![]()
![]() 。
。
请回答:
(1)①根据相关物质的相对能量计算![]() _____
_____![]() 。
。
②下列描述正确的是_____
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
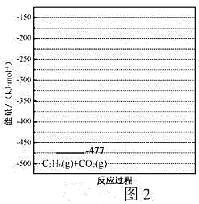
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:![]()
![]()
![]() ,且第二步速率较慢(反应活化能为
,且第二步速率较慢(反应活化能为![]() )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从![]() 的能量
的能量![]() ,开始(如图2)_____
,开始(如图2)_____
。
(2)①![]() 和
和![]() 按物质的量1:1投料,在
按物质的量1:1投料,在![]() 和保持总压恒定的条件下,研究催化剂X对“
和保持总压恒定的条件下,研究催化剂X对“![]() 氧化
氧化![]() 制
制![]() ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表:
催化剂 | 转化率 | 转化率 | 产率 |
催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,![]() 氧化
氧化![]() 的主要产物是______,判断依据是_______。
的主要产物是______,判断依据是_______。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高![]() 的选择性(生成
的选择性(生成![]() 的物质的量与消耗
的物质的量与消耗![]() 的物质的量之比)。在
的物质的量之比)。在![]() ,乙烷平衡转化率为
,乙烷平衡转化率为![]() ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到
,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到![]() 。结合具体反应说明乙烷转化率增大的原因是_____。
。结合具体反应说明乙烷转化率增大的原因是_____。