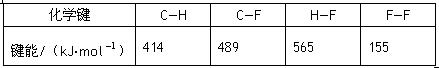
题目内容
已知CH4(g)+2O2(g) == CO2(g)+2H2O(l); ΔH=–Q1kJ·mol-1 ,
2H2(g)+O2(g)=2H2O(g);△H2=–Q2 kJ·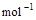 ,
,
2H2(g)+O2(g) =2H2O(l);△H2=–Q3 kJ·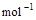 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为
2H2(g)+O2(g)=2H2O(g);△H2=–Q2 kJ·
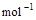 ,
,2H2(g)+O2(g) =2H2O(l);△H2=–Q3 kJ·
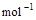 。
。常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为
| A. 0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.2Q2 |
A
混合气体为0.5mol,其中甲烷和氢气分别为0.4mol与0.1mol,而在题目所给条件下,水为液态,故放出的热量为0.4Q1+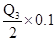 =0.4Q1+0.05Q3
=0.4Q1+0.05Q3
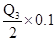 =0.4Q1+0.05Q3
=0.4Q1+0.05Q3 
练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 2NH3(g) ΔH="-92.4" KJ/mol,则N≡N键的键能是 ( )
2NH3(g) ΔH="-92.4" KJ/mol,则N≡N键的键能是 ( )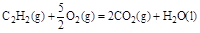 ;△H=-1300kJ/mol的说法中,正确的是( )
;△H=-1300kJ/mol的说法中,正确的是( ) )
) 2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________
2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________ 部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍
部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍 8K时的热化学反应方程式:(3分)
8K时的热化学反应方程式:(3分) ,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )
,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )