题目内容
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式 ___________________。
(2)碳的燃烧热为393.50kJ·mol-1,写出表示C燃烧热的热化学方程式:____________________________________________。
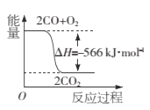
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式: _______________________________________________。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8kJ/mol
O2(g)=H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式____________________。
【答案】![]() H2SO4(aq)+NaOH(aq)═
H2SO4(aq)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l) △H=-57.3 kJ/mol C(s)+O2(g)═CO2(g) △H=-393.5 kJmol-1 2CO(g)+O2(g)═2CO2(g) △H=-566kJmol-1 2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol
Na2SO4(aq)+H2O(l) △H=-57.3 kJ/mol C(s)+O2(g)═CO2(g) △H=-393.5 kJmol-1 2CO(g)+O2(g)═2CO2(g) △H=-566kJmol-1 2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol
【解析】
(1)中和热的概念分析,中和热是指强酸、强碱生成1mol水放出的热量;
(2)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写;
(3)根据图象书写热化学方程式;
(4)利用盖斯定律计算反应热,并书写热化学方程式。
(1)中和热是指强酸、强碱生成1mol水放出的热量,1mol H2SO4与NaOH溶液恰好完全反应时,生成2mol水,放出114.6kJ热量,则生成1mol水时放出57.3kJ的热量,所以表示H2SO4与NaOH反应的中和热的热化学方程式为:![]() H2SO4(aq)+NaOH(aq)═
H2SO4(aq)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)已知碳的燃烧热为393.5kJ/mol,则表示碳的燃烧热的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-393.5 kJmol-1;
(3)由图象可知2molCO和 1mol氧气生成2mol二氧化碳放出566kJ的热量,所以热化学方程式为2CO(s)+O2(g)═2CO2(s) △H=-566kJmol-1;
(4)已知:①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) △H1=-870.3kJ/mol,②C(s)+O2(g)═CO2(g) △H2=-393.5kJ/mol,③H2(g)+![]() O2(g)═H2O(l) △H3=-285.8kJ/mol,利用盖斯定律将②×2+③×2-①可得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol。
O2(g)═H2O(l) △H3=-285.8kJ/mol,利用盖斯定律将②×2+③×2-①可得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A 是制取 CO2 的装置,可选用的试剂_____(填序号)
①碳酸钙固体与稀硫酸 ②碳酸钠固体与稀盐酸 ③碳酸氢钠固体与氢氧化钠溶液
写出对应的离子方程式_________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和 NaHCO3 溶液 | ____________ |
C | ____________ | 与 CO2 和水反应产生 O2 |
D | NaOH 溶液 | ____________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式_____。
(4)用_____检验 F 中收集到的气体,现象是_____。