题目内容
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
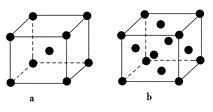
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。

(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
(1)sp3 Na<Cl<F NaF(1分) HF和H2O分子之间能形成氢键
(2)1S22S22P63S23d104S1或〔Ar〕3d104S1(2分) 2∶1
(3)TiN>MgO>CaO>KCl
(4)CrO2
(5)6 2
(2)1S22S22P63S23d104S1或〔Ar〕3d104S1(2分) 2∶1
(3)TiN>MgO>CaO>KCl
(4)CrO2
(5)6 2
由题干信息可知,五种元素分别是:A-N B-Na C-F D-Cl E-Cu
(1)元素A简单氢化物是NH3,NH3中N采取sp3杂化,
(2)用切割法计算图a和b中的Cu原子
(3)晶格能越大熔点越高
(4)V2O5中V 没有未成对电子,CrO2中Cr含有2个未成对电子
(5)CO2中有2个σ键和2个π键,4H2有4个σ键
(1)元素A简单氢化物是NH3,NH3中N采取sp3杂化,
(2)用切割法计算图a和b中的Cu原子
(3)晶格能越大熔点越高
(4)V2O5中V 没有未成对电子,CrO2中Cr含有2个未成对电子
(5)CO2中有2个σ键和2个π键,4H2有4个σ键

练习册系列答案
相关题目


 , 试回答:
, 试回答: