题目内容
【题目】我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) △H=_________,K=__________。
W(s)+3H2O(g) △H=_________,K=__________。
(3)T1℃时,将一定质量WO3和8.0gH2置于2L密闭容器中,发生反应: WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
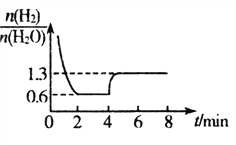
①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4min时降低并维持温度为T2℃,则该反应的△H_______0,若在8min时缩小容器容积,则![]() _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
【答案】 ![]()
![]()
![]()
![]() 62.5 4.6 > =
62.5 4.6 > =
【解析】(1)盐能与酸反应,生成新酸与新盐,白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀H2WO4,灼烧沉淀H2WO4即可得到WO3,化学方程式为:CaWO4+2HCl=H2WO4↓+CaCl2 ,H2WO4![]() WO3+H2O 。(2)① WO3(s)+0.1H2(g)
WO3+H2O 。(2)① WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1,②WO2.9(s)+0.18H2(g)
WO2.9(s)+0.1H2O(g) △H1 K1,②WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2,③WO2.72(s)+0.72H2(g)
WO2.72(s)+0.18H2O(g) △H2 K2,③WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3,④WO2(s)+2H2(g)
WO2(s)+0.72H2O(g) △H3 K3,④WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4,根据盖斯定律,将①+②+③+④得该温度下,WO3(s)+3H2(g)
W(s)+2H2O(g) △H4 K4,根据盖斯定律,将①+②+③+④得该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) △H=ΔH1+ΔH2+ΔH3+ΔH4,k=K1K2K3K4;(3)①n(H2)=8.0g/2g·mol-1=4mol
W(s)+3H2O(g) △H=ΔH1+ΔH2+ΔH3+ΔH4,k=K1K2K3K4;(3)①n(H2)=8.0g/2g·mol-1=4mol
WO3(s)+3H2(g)![]() W(s)+3H2O(g)
W(s)+3H2O(g)
n始 4
n变 -x x
n平 4-x x
由图n(H2):n(H2O)=(4-x):x=0.6,x=2.5mol,T1℃时,H2的平衡转化率a=2.5/4=0.625;反应平衡常数K=1.253/0.753=4.6;②若在4min时降低并维持温度为T2℃,温度降低,平衡逆向移动,则该反应的△H>0,若在8min时缩小容器容积,平衡不移动,则![]() =1.3。
=1.3。

【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】A
【解析】A. 据图可知,加入40mLNaHCO3溶液时生成沉淀最多,沉淀为0.032mol,因NaOH过量,则滤液中含有NaOH,由反应顺序OH+HCO3=CO32+H2O、HCO3+AlO2+H2O═Al(OH)3↓+ CO32并结合图象可知,加入前8mLNaHCO3溶液时不生成沉淀,则原NaHCO3溶液中c(NaHCO3)= ![]() =1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
=1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
【题型】单选题
【结束】
8
【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。
)。
反应如下: +ClC(CH3)3
+ClC(CH3)3 +HCl
+HCl
已知下列信息:
物质 | 相对分子质量 | 密度 | 熔点 | 沸点 | 溶解性 |
AlCl3 | —— | —— | 190℃ | 180℃ | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88g/cm3 | —— | 80.1℃ | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.84 g/cm3 | —— | 51.6℃ | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 g/cm3 | —— | 169℃ | 难溶于水,易溶于苯 |
I、如下图是实验室制备无水AlCl3的实验装置:

(1)E装置中的仪器名称是_______________。
(2)写出B装置中发生反应的离子方程式:________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________ (写导管口标号)。
(4)下列操作正确的是________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:_______________________。
II、实验室制取叔丁基苯装置如图:

在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是___________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是_____________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为______。(保留3位有效数字)



