题目内容
在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为| A.2:1 | B.1:1 | C.2:3 | D.3:2 |
B
假设起始的X和Y分别为x、ymol,反应X为amol,Y为2amol;有a/x=25%;2a/y=50%;故x:y=1:1。

练习册系列答案
相关题目
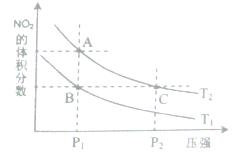
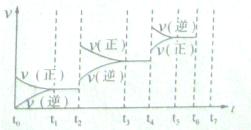
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,
 pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是
pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。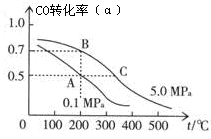
 CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
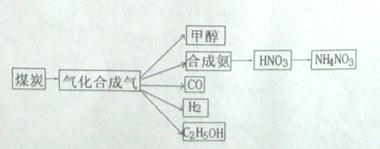
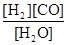 ,它所对应的化学反应为:
,它所对应的化学反应为:  2C0(g),K1 ①
2C0(g),K1 ① K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。