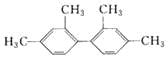
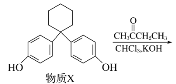
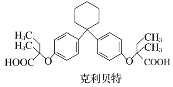
题目内容
【题目】有平衡体系CO(g)+2H2(g)====CH3OH(g) ΔH<0,为增加甲醇的产量,应采取的正确措施是( )
A.高温、高压B.适宜的温度、高压、催化剂
C.低温、低压D.高温、高压、催化剂
【答案】B
【解析】
分析反应特点,正反应放热、气体物质分子数减小的反应。再分析题目要求,为了增加甲醇的产量,即生成甲醇的反应速率要大,且甲醇的平衡浓度也尽可能大,最后,根据理论和实际相结合做出判断:
反应速率分析 | 化学平衡分析 | 综合选择 | |
温度 | 高温 | 低温 | 适宜温度 |
压强 | 高压 | 高压 | 高压 |
催化剂 | 使用催化剂 | 无影响 | 使用催化剂 |
即答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】液氨作为一种潜在的清洁汽车燃料已越来越被重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。
(1)氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的ΔH=_____。(请用含有ΔH1、ΔH2的式子表示)
(2)氨气可以直接用于燃料电池,选择碱性溶液作为电解质溶液,写出负极的电极反应式__________。
(3)已知合成氨反应的方程式为N2+3H2![]() 2NH3,其平衡常数K的数值和温度的关系如下:
2NH3,其平衡常数K的数值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
①由上表数据可知该反应ΔH______0(填“>”或“<”)。
②400℃时,测得某时刻c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,此时刻该反应的v正____v逆(填“>”“=”或“<”)。
(4)下图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后合成NH3,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是__________________。
②关于合成氨的反应,下列叙述正确的是________。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 图中M、Q点平衡常数K的关系是K(M)>K(Q)
③M点对应的H2的转化率是____________________。
④400℃时,将1mol N2和3mol H2充入恒压密闭容器中,下图分别代表焓变(ΔH)、混合气体平均相对分子质量(M)、N2质量分数[φ(N2)]和混合气体密度(ρ)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是_____________________。