题目内容
重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
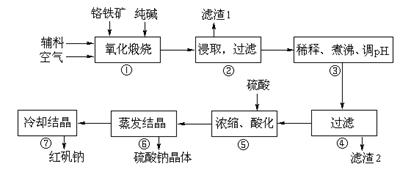
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
试回答下列问题:
⑴ “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ▲ 。两个副反应均为吸热反应,但在高温下均能自发进行,其原因是 ▲ 。
⑵ “③”中调节pH至4.7,目的是 ▲ 。
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ▲ 。
⑷ “⑦”中采用冷却结晶的方法析出红矾钠,依据是 ▲ 。

①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2副反应:SiO2+Na2CO3
 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
⑴ “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ▲ 。两个副反应均为吸热反应,但在高温下均能自发进行,其原因是 ▲ 。
⑵ “③”中调节pH至4.7,目的是 ▲ 。
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ▲ 。
⑷ “⑦”中采用冷却结晶的方法析出红矾钠,依据是 ▲ 。
⑴ 使反应物接触更充分,加快反应速率 有气体生成,△S>0
⑵除去溶液中的AlO2—、SiO32—
⑶ 2CrO42-+2H+ Cr2O72-+H2O ⑷ 红矾钠的溶解度随温度的降低而减小 (每空2分,共10分)
Cr2O72-+H2O ⑷ 红矾钠的溶解度随温度的降低而减小 (每空2分,共10分)
⑵除去溶液中的AlO2—、SiO32—
⑶ 2CrO42-+2H+
 Cr2O72-+H2O ⑷ 红矾钠的溶解度随温度的降低而减小 (每空2分,共10分)
Cr2O72-+H2O ⑷ 红矾钠的溶解度随温度的降低而减小 (每空2分,共10分)作为反应流程题,本题思路比较清晰,题项设置简单。(1)中两个副反应均为吸热反应,能自发进行的动力在于熵增,即△S>0;(2)中难以回答到位,要从副反应考虑,Na2SiO3、 NaAlO2作为杂质要除去,不能局限于表格;(3)是平衡,2CrO42-+2H+ Cr2O72-+H2O;(4)从溶解度上分析。
Cr2O72-+H2O;(4)从溶解度上分析。
 Cr2O72-+H2O;(4)从溶解度上分析。
Cr2O72-+H2O;(4)从溶解度上分析。
练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目


 (1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。
(1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。