题目内容
实验室用下列仪器和药品制取干燥纯净的氯气.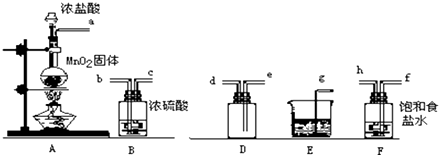
(1)、按气流从左到右,装置正确的连接
(2)装置F的作用是
(3)装置A和E中的反应化学方程式为
A
E
(4)若有8.7gMnO2参加了反应,将产生的氯气通入足量的KI溶液中能产生单质碘的质量
分析:(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)根据除杂方法和氯气的化学性质解答;装置F的作用除去Cl2中混有的HCl气体;装置E的作用是吸收尾气中的Cl2;
(3)根据制取氯气的反应原理和氯气的化学性质思考;利用浓盐酸和二氧化锰加热反应制取氯气,利用碱液吸收尾气;
(4)根据MnO2+4HCl(浓)
MnCl2+Cl2+2H2O和Cl2+2KI=2KCl+I2化学方程式计算.
(2)根据除杂方法和氯气的化学性质解答;装置F的作用除去Cl2中混有的HCl气体;装置E的作用是吸收尾气中的Cl2;
(3)根据制取氯气的反应原理和氯气的化学性质思考;利用浓盐酸和二氧化锰加热反应制取氯气,利用碱液吸收尾气;
(4)根据MnO2+4HCl(浓)
| ||
解答:解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;B为氯气的制取装置,浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,所以制取的氯气中含有水蒸气和氯化氢,由于氯气难溶于饱和食盐水,可用饱和食盐水除去氯化氢气体,然后用浓硫酸干燥得到了干燥、纯净的氯气,用向下排空气法收集氯气,最后要吸收多余的氯气,即仪器连接顺序为:a接f接h接b接c接e接d接g,
故答案为:a;f;h;b;c;e;d;g;
(2)制取氯气时需要加热,会使浓盐酸挥发出来,Cl2不溶于饱和食盐水,而HCl溶于饱和食盐水,所以可以用装置F使用饱和食盐水除去HCl;氯气有毒,可用NaOH溶液进行尾气处理,防止其造成空气污染;
故答案为:除去Cl2中混有的HCl气体;吸收尾气中的Cl2;
(3)装置A利用浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水制取氯气,发生反应的化学方程式是MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
装置E用氢氧化钠溶液吸收多余的氯气,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,所以氯气与氢氧化钠反应的化学方程式是Cl2+2NaOH=NaCl+NaCl-+H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;Cl2+2NaOH=NaCl+NaClO+H2O;
(4)n(MnO2)=
=
═0.1mol,根据MnO2+4HCl(浓)
MnCl2+Cl2+2H2O可知,0.1mol二氧化锰参加反应能生成0.1molCl2,根据Cl2+2KI=2KCl+I2可知,0.1molCl2反应能生成0.1mol单质I2,m(I2)=n×M=0.1mol×254g/mol=25.4g,
故答案为:25.4.
故答案为:a;f;h;b;c;e;d;g;
(2)制取氯气时需要加热,会使浓盐酸挥发出来,Cl2不溶于饱和食盐水,而HCl溶于饱和食盐水,所以可以用装置F使用饱和食盐水除去HCl;氯气有毒,可用NaOH溶液进行尾气处理,防止其造成空气污染;
故答案为:除去Cl2中混有的HCl气体;吸收尾气中的Cl2;
(3)装置A利用浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水制取氯气,发生反应的化学方程式是MnO2+4HCl(浓)
| ||
装置E用氢氧化钠溶液吸收多余的氯气,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,所以氯气与氢氧化钠反应的化学方程式是Cl2+2NaOH=NaCl+NaCl-+H2O,
故答案为:MnO2+4HCl(浓)
| ||
(4)n(MnO2)=
| m |
| M |
| 8.7g |
| 87g/mol |
| ||
故答案为:25.4.
点评:本题考查了实验室制取氯气以及有关化学方程式的计算,掌握实验室制备氯气的原理以及氯气的化学性质是解答的关键,题目难度中等.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)