题目内容
对可逆反应N2 (g)+3H2(g)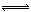 2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )
2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )
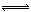 2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )
2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )| A.达到化学平衡时,若增加容器体积,则正反应速率减小 ,逆反应速率增大 |
| B.若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 |
| C.达到化学平衡时,2v正(H2)=3v逆(NH3) |
| D.加入催化剂,正反应速率增大,逆反应速率不变 |
C
试题分析:A选项若增加容器体积,反应物生成物的浓度都减小,所以正逆反应速率都减小。B选项描述的都是逆反应,错误。C选项达到平衡时,正逆反应速率相等,不同物质符合系数比,正确。D选项催化剂会同等程度的改变正逆反应速率。
点评:本题为常规考题,需要抓住化学平衡的特征,对化学反应速率要分析透彻。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
 C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是 C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题: 2SO3,下列判断正确的是
2SO3,下列判断正确的是 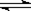 ?CH3OH(g)。
?CH3OH(g)。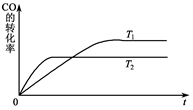
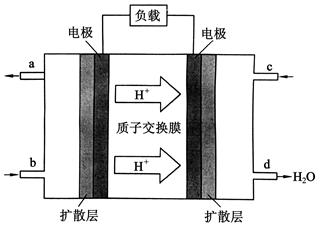
 CO(g)+H2(g) , 试分析和回答下列问题:
CO(g)+H2(g) , 试分析和回答下列问题: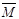 的取值范围是 。
的取值范围是 。 Z(g)(未配平)。温度为T0时,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平)。温度为T0时,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是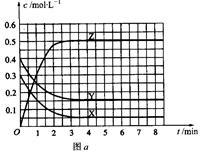
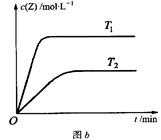
 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题: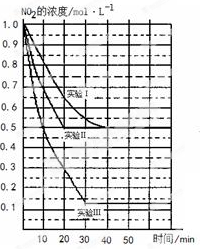
 _________(填“正向移动”或“逆向移动”或“不移动”)
_________(填“正向移动”或“逆向移动”或“不移动”) SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比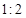 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题: