题目内容
13.有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.(1)B在周期表中的位置第二周期ⅥA族.
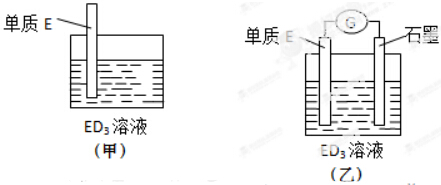
(2)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为Fe+2Fe3+=3Fe2+.
(3)依据(2)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为2Fe3++2e-=2Fe2+.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是石墨为正极,使还原反应和氧化反应在电解质溶液中的不同区域内发生.
分析 有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(3)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+.
解答 解:有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)B为O元素,原子核外有2个电子层,最外层电子数为6,处于周期表中:第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(3)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,负极电极反应式为:Fe-2e-=Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+,正极电极反应式为:2Fe3++2e-=2Fe2+,使还原反应和氧化反应在电解质溶液中的不同区域内发生,
故答案为:2Fe3++2e-=2Fe2+;石墨为正极,使还原反应和氧化反应在电解质溶液中的不同区域内发生.
点评 本题考查结构性质位置关系应用、电化学知识,题目难度不大,推断元素的种类为解答关键,注意理解掌握电极反应式的书写.

| A. | 生石灰 | B. | 干冰 | C. | 石灰石 | D. | 漂白粉 |
| A. | 能与NaOH溶液反应 | |
| B. | 能使品红溶液褪色 | |
| C. | 见光能分解 | |
| D. | 向Ca(ClO)2 溶液中通入CO2能生成次氯酸 |
| A. | 推广使用一次性纸杯 | |
| B. | 用天然气替代煤作燃料 | |
| C. | 开发利用太阳能 | |
| D. | 鼓励公民用私家车替代公共交通出行 |
| A. | $\frac{a+b}{4}$ | B. | $\frac{3a+2b}{4}$ | C. | 4(a+b) | D. | 4(3a+b) |
| A. | 容器内压强不随时间变化而变化 | |
| B. | 单位时间消耗0.1mol X同时生成0.3mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:3 | |
| D. | 容器内各物质的浓度不随时间变化而变化 |
| A. | 电解水:2H20═2H2↑+O2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+H2O═4HF+O2 | D. | 3NO2+H2O═2HNO3+NO |
①Na2SiO3②CaCO3③CaSiO3④SiO2⑤Na2CO3.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④ | D. | ③④⑤ |

 .
.