题目内容
【题目】乙醇是一种常用的工业燃料,燃料乙醇的生产过程可由下图表示:
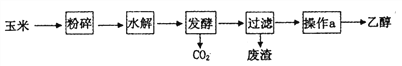
(1)粉碎玉米的目的是____________。
(2)生产过程中检验玉米中是否完全水解的方法是_________。
(3)请写出“发酵”过程中反应的化学方程式_____________;发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:______________________、________________________
(4)操作a的名称是_________,检验乙醇中是否含有水可以用试剂______。
(5)根据上述生产过程,用5吨含淀粉70%的玉米,假设淀粉水解的百分率为85%,发酵过程的转化率为60%,则最终可以制得无水乙醇________kg(小数点后保留一位有效数字)。
【答案】 增大反应物的接触面积,提高反应速率 取少量水解产物,加入碘水,若变蓝,则淀粉未完全水解,若不变蓝,则已完全水解 C6H12O6→2C2H5OH+2CO2 制饮料 制干冰或制纯碱 蒸馏 无水硫酸铜 1013.7
【解析】燃料乙醇的生产过程为:玉米中含有淀粉,粉粹增大接触面积,淀粉水解生成葡萄糖,葡萄糖发酵分解为C2H5OH和CO2,过滤掉废渣后,对滤液蒸馏得到乙醇.
(1)玉米中含有淀粉,粉碎玉米可以增大淀粉的接触面积,加快水解反应的速率,使反应充分进行;
(2)淀粉遇碘变蓝色,可利用此性质检验淀粉是否水解完全,具体操作方法是:取少量水解产物,加入碘水,若变蓝,则淀粉未完全水解,若不变蓝,则已完全水解;
(3)“发酵”过程中反应的化学方程式为C6H12O6→2C2H5OH+2CO2,二氧化碳可以制碳酸饮料、制干冰、制纯碱、制碳酸钙等;
(4)淀粉水解生成葡萄糖,葡萄糖发酵分解为C2H5OH和CO2,过滤掉废渣后,乙醇的沸点较低,可利用蒸馏操作把乙醇从滤液中分离出来;利用无水硫酸铜粉末检验酒精中是否有水,如果有水会变蓝色;
(5)设可得酒精质量为mKg,则:
(C6H10O5)n (淀粉)~2nCH3CH2OH
162n 92n
5×103Kg×70%×85% mKg
故162n︰92n=(5×103Kg×70%×85%)︰m
解得m≈1013.7。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】下表是有机物A、B的有关信息。
A | B |
①能使溴的四氯化碳溶液退色 ②比例模型为: ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: |
根据表中信息回答下列问题:
(1)写出在一定条件下,A生成高分子化合物的化学反应方程式_____________________________________________。
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=____时,这类有机物开始出现同分异构体。
(3)B具有的性质是____(填序号)。
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水
反应使之退色、⑥任何条件下不与氢气反应。
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
________________________________________________________________________。
