题目内容
10.填空:(1)标准状况下,1mol H2的体积是22.4L.
(2)标准状况下,3mol CO2的体积是67.2L.
(3)标准状况下,1.12L O2物质的量是0.05mol.
(4)标准状况下,4.48L N2物质的量是0.2mol
(5)标准状况下,6.02×1022个O2的所占的体积为2.24L.
(6)标准状况下,5.6L CO2中含有CO2分子数为0.25NA.
(7)标准状况下,2.2g CO2的体积是1.12L.
(8)标准状况下,11.2L N2的质量是14g.
(9)2mol O3和3mol O2的质量比1:1;分子数之比为:2:3;O原子数目之比为1:1;相同条件下的体积比为2:3.
分析 结合V=nVm、n=$\frac{m}{M}$、N=nNA及分子构成计算.
解答 解:(1)标准状况下,1mol H2的体积是1mol×22.4L/mol=22.4L,故答案为:22.4L;
(2)标准状况下,3mol CO2的体积是3mol×22.4L/mol=67.2L,故答案为:67.2L;
(3)标准状况下,1.12L O2物质的量是$\frac{1.12L}{22.4L/mol}$=0.05mol,故答案为:0.05mol;
(4)标准状况下,4.48L N2物质的量是$\frac{4.48L}{22.4L/mol}$=0.2mol,故答案为:0.2mol;
(5)标准状况下,6.02×1022个O2的所占的体积为$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$×22.4L/mol=2.24L,故答案为:2.24L;
(6)标准状况下,5.6L CO2中含有CO2分子数为$\frac{5.6L}{22.4L/mol}$×NA=0.25NA,故答案为:0.25NA;
(7)标准状况下,2.2g CO2的体积是$\frac{2.2g}{44g/mol}$×22.4L/mol=1.12L,故答案为:1.12L;
(8)标准状况下,11.2L N2的质量是$\frac{11.2L}{22.4L/mol}$×28g/mol=14g,故答案为:14g;
(9)2mol O3和3mol O2的质量比为2mol×48g/mol:3mol×32g/mol=1:1;分子数之比等于物质的量之比为2:3;O原子均为6mol,O原子数目之比为1:1;相同条件下的体积比等于物质的量之比,为2:3,故答案为:1:1;2:3;1:1;2:3.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
 ,④离子的核外电子排布示意图
,④离子的核外电子排布示意图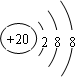 .
.⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:H3PO4、HClO4;
⑦元素气态氢化物的稳定性小于⑨元素气态氢化物的稳定性(填大于、等于或小于)
(2)失电子能力最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑
(3)写出③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
| A. | 0.32mol NaCl、0.01mol KCl、0.12mol Na2S04 | |
| B. | 0.02mol NaCl、0.64mol KCl、0.24mol Na2S04 | |
| C. | 0.64mol NaCl、0.04mol KCl、0.24mol Na2S04 | |
| D. | 0.64mol NaCl、0.02mol KCl、0.24mol Na2S04 |