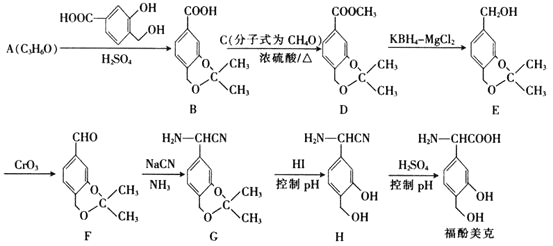
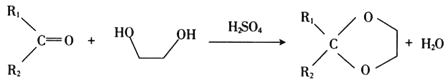
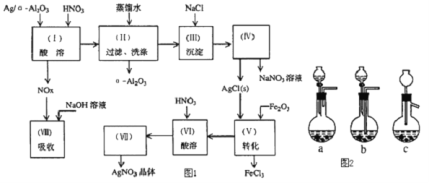
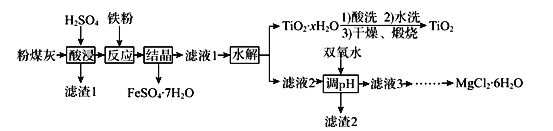
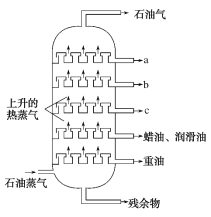
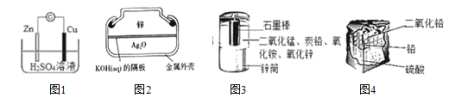
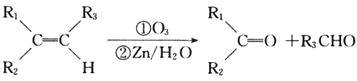题目内容
【题目】ⅰ.有下列物质:①铜;②硫酸钡固体;③氨水;④氢氧化钠固体;⑤熔融硝酸钾;⑥乙醇;⑦盐酸;⑧金刚石;⑨二氧化硫;⑩冰醋酸。
其中能导电的有_______;(填序号,下同)属于非电解质的有_____;属于强电解质的有_____;
ⅱ.写出①H2SO3 ②CH3COONH4在水中的电离方程式:
___________________________________________________________;
___________________________________________________________。
【答案】①③⑤⑦ ⑥⑨ ②④⑤ H2SO3![]() H++HSO3- CH3COONH4=NH4++CH3COO-
H++HSO3- CH3COONH4=NH4++CH3COO-
【解析】
ⅰ.①铜是金属单质,能导电,不是电解质也不是非电解质;②硫酸钡固体是盐,属于电解质。熔融状态下能完全电离,是强电解质;③氨水是混合物,能导电,不是电解质也不是非电解质;④氢氧化钠固体是电解质,由于是固体,所以不能导电;在水中或熔融状态下能完全电离,是强电解质;⑤熔融硝酸钾是电解质,因为在熔融态,因此可以导电;在水中或熔融状态下能完全电离,是强电解质;⑥乙醇是非电解质,不能导电;⑦盐酸是混合物,能导电,不是电解质也不是非电解质;⑧金刚石是非金属单质,不能导电,不是电解质也不是非电解质;⑨二氧化碳是非电解质,不能导电;⑩冰醋酸是电解质,由于都是以电解质分子的形式存在,所以不能导电。在水溶液中存在电离平衡,因此是弱电解质。因此其中能导电的有①③⑤⑦;属于非电解质的有⑥⑨;属于强电解质的有②④⑤ ;
ⅱ.H2SO3是二元弱酸,在水中电离出H+和HSO3-,电离方程式为:H2SO3![]() H++HSO3-;CH3COONH4水中完全电离出NH4+和CH3COO-,电离方程式为:CH3COONH4=NH4++CH3COO-。
H++HSO3-;CH3COONH4水中完全电离出NH4+和CH3COO-,电离方程式为:CH3COONH4=NH4++CH3COO-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案