题目内容
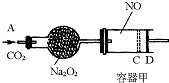 如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的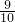 ,随着CO2的继续通入,活塞又逐渐向右移动.(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动.(不考虑活塞的磨擦)
已知:2Na2O2+2CO2→2Na2CO3+O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24g.
①此时,通入标准状况下的CO2气体多少L?
②容器甲中NO2转化为N2O4的转化率是多少?
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必______0.01(填大于、小于、等于),其理由是______.
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于______g.
解:(1)①设通入标准状况下CO2气体的体积为x,产生氧气的体积为y,则:
2Na2O2+2CO2=2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,
56 g:2.24g=22.4 L:y,解得y=0.896L,
答:通入标准状况下的CO2气体1.792L.
②由①计算可知,生成氧气的物质的量n(O2)=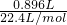 =0.04mol,
=0.04mol,
2NO+O2=2NO2
2 1 2
0.08mol 0.04 mol 0.08 mol
0.1 mol>0.08 mol,所以NO过量,生成NO2的物质的量为0.08 mol.
所以2NO2?N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-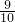 )=0.01mol
)=0.01mol
所以NO2转化为N2O4的转化率为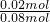 ×100%=25%,
×100%=25%,
答:NO2转化为N2O4的转化率为25%.
③活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,
故答案为:小于;活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(2)实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动(此反应为放热反应).
即降温时 2NO2?N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-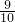 )
)
即容器中至少应有0.02 mol的NO2,
根据转化关系式可知:2Na2O2→O2→2NO→2NO2,至少需要Na2O20.02 mol,所以其质量最小值为0.02 mol×78 g/mol=1.56 g.
故答案为:1.56g.
分析:(1)①干燥管内质量增重,由于发生反应2Na2O2+2CO2=2Na2CO3+O2,利用差量法计算参加反应的二氧化碳的体积;
②容器甲中发生反应2NO+O2=2NO2,2NO2?N2O4,根据①计算生成氧气的体积,进而计算n(O2),根据过量计算,判断氧气与NO反应生成的二氧化氮的物质的量,此过程容器甲的体积不变,此后由于发生反应2NO2?N2O4,甲容器的体积减小,根据体积变化,判断混合气体物质的量减少量,根据差量法计算参加反应的二氧化氮的物质的量,再根据转化率定义计算;
③活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(2)实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动(此反应为放热反应),气体物质的量减少量,根据差量法计算至少含有二氧化氮的物质的量,再根据关系式2Na2O2→O2→2NO→2NO2,计算过氧化钠的最少物质的量,再根据m=nM计算.
点评:考查NO、CO2和过氧化钠反应的有关计算与判断,试题综合性强,过程复杂,计算量很大,难度很大,为易错题目,该题是高考中的常见考点和题型,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,侧重对学生能力的培养和解题方法的指导与训练.
2Na2O2+2CO2=2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,
56 g:2.24g=22.4 L:y,解得y=0.896L,
答:通入标准状况下的CO2气体1.792L.
②由①计算可知,生成氧气的物质的量n(O2)=
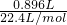 =0.04mol,
=0.04mol,2NO+O2=2NO2
2 1 2
0.08mol 0.04 mol 0.08 mol
0.1 mol>0.08 mol,所以NO过量,生成NO2的物质的量为0.08 mol.
所以2NO2?N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-
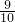 )=0.01mol
)=0.01mol所以NO2转化为N2O4的转化率为
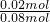 ×100%=25%,
×100%=25%,答:NO2转化为N2O4的转化率为25%.
③活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,
故答案为:小于;活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(2)实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动(此反应为放热反应).
即降温时 2NO2?N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-
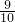 )
)即容器中至少应有0.02 mol的NO2,
根据转化关系式可知:2Na2O2→O2→2NO→2NO2,至少需要Na2O20.02 mol,所以其质量最小值为0.02 mol×78 g/mol=1.56 g.
故答案为:1.56g.
分析:(1)①干燥管内质量增重,由于发生反应2Na2O2+2CO2=2Na2CO3+O2,利用差量法计算参加反应的二氧化碳的体积;
②容器甲中发生反应2NO+O2=2NO2,2NO2?N2O4,根据①计算生成氧气的体积,进而计算n(O2),根据过量计算,判断氧气与NO反应生成的二氧化氮的物质的量,此过程容器甲的体积不变,此后由于发生反应2NO2?N2O4,甲容器的体积减小,根据体积变化,判断混合气体物质的量减少量,根据差量法计算参加反应的二氧化氮的物质的量,再根据转化率定义计算;
③活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(2)实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动(此反应为放热反应),气体物质的量减少量,根据差量法计算至少含有二氧化氮的物质的量,再根据关系式2Na2O2→O2→2NO→2NO2,计算过氧化钠的最少物质的量,再根据m=nM计算.
点评:考查NO、CO2和过氧化钠反应的有关计算与判断,试题综合性强,过程复杂,计算量很大,难度很大,为易错题目,该题是高考中的常见考点和题型,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,侧重对学生能力的培养和解题方法的指导与训练.

练习册系列答案
相关题目
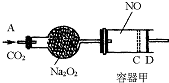 (2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
(2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的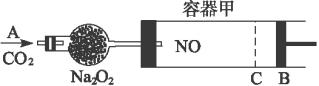
 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)