题目内容
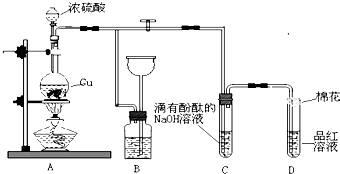
15.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:(1)装置A中发生的化学反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是④(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是氢氧化钠溶液等碱性溶液.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是②③(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色
分析 浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑,反应生成的SO2具有酸性和还原性,可用排饱和NaHSO3溶液收集,具有漂白性,可使品红溶液褪色,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应,结合题目要求解答该题.
解答 解:(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑,故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+2SO2↑;
(2)B装置的作用是贮存气体,所以B中盛放液体不能和二氧化硫反应,水、酸性高锰酸钾及Na2CO3溶液都能和二氧化硫反应,只有亚硫酸氢钠和二氧化硫不反应,故答案为:④;
(3)无色酚酞遇碱变红色,二氧化硫属于酸性氧化物,能和NaOH反应生成亚硫酸钠和水,导致酚酞褪色;二氧化硫和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,所以二者褪色原理不同,二氧化硫和氢氧化钠离子反应方程式为SO2+2OH-=SO32-+H2O,
故答案为:与氢氧化钠溶液反应使酚酞试液变为无色;SO2+2OH-=SO32-+H2O;
(4)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收,所以棉花蘸取的溶液可以为NaOH溶液等碱性溶液,故答案为:氢氧化钠溶液等碱性溶液;
(5)①观察稀硫酸溶液呈无色,可说明SO42-无色;
②观察CuSO4粉末呈白色,不能证明蓝色只与Cu2+有关;
③稀释CuSO4溶液,溶液蓝色变浅,因阳离子和阴离子浓度都变浅,不能证明;
④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色,铜离子浓度减小,可说明与铜离子有关;
⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍呈蓝色,铜离子物质的量不变,可说明与铜离子有关,
则对实验目的没有意义的是②③,
故答案为:②③.
点评 本题综合考查性实验设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握相关物质的性质以及实验原理.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | HCl | B. | CH3COOH | C. | 蔗糖 | D. | Na2CO3 |

| A. | 溶液中HCO3-的数目 | B. | 溶液的pH | ||
| C. | CO32- 水解的平衡常数 | D. | 溶液中的c(CO32-) |
 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| B. | Ⅱ中的澄清石灰水变浑浊 | |
| C. | Ⅲ中紫色石蕊试液变红 | |
| D. | 鸡蛋壳发生了分解反应 |
【实验】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
【提出假设】
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计实验方案验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验 方案 | 实验操作 | 实验 现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物 质为 Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显 现象 |
(1)写出金属镁与二氧化碳反应的化学反应方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)甲同学认为方案1得到的结论不正确,其理由是Na2CO3溶液显碱性,也会使酚酞变红,且也有可能是Na2O和Na2CO3的混合物.
(3)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.
(4)通过方案1和方案2的实验,你认为上述三个假设中,假设2成立.你的理由是方案2①中出现的白色沉淀是CaCO3或Ca(OH)2;方案2②中滴加无色酚酞试液无明显现象,说明燃烧后的白色产物中没有Na2O存在,所以燃烧后的白色产物中仅有Na2CO3,白色沉淀为CaCO3.
(5)钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2CO3+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素,违背质量守恒定律.
已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)写出A的电子式
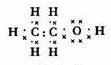 .
.(2)反应Ⅱ的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
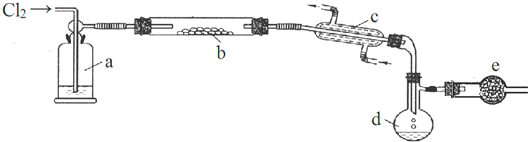
.(4)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子2 mol | |
| C. | Na2O2只作氧化剂 | |
| D. | Na2O2只作还原剂 |
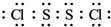 ;
;