题目内容
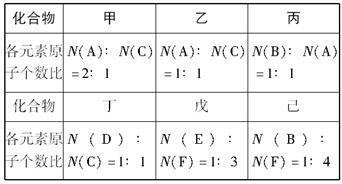
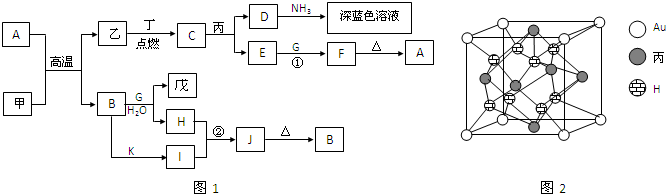
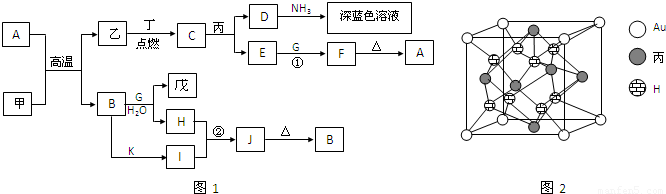
甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1.它们之间有如图1的转化关系(部分反应物或产物省略).
回答以下问题:
(1)G的电子式:
 ,深蓝色溶液中溶质的化学式:
,深蓝色溶液中溶质的化学式:
(2)甲与同周期的金属元素相比,第一电离能由小到大的顺序是
(3)完成反应方程式
反应①中,E和G的物质的量之比为2:1:
反应②的离子方程式:
(4)乙的高价阳离子的最高能级电子排布图为:
 .检验该离子常用KSCN溶液.乙的高价阳离子与SCN-可形成配位数不同的多种配合物.在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,所得配合物是下列中的
.检验该离子常用KSCN溶液.乙的高价阳离子与SCN-可形成配位数不同的多种配合物.在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,所得配合物是下列中的
①[Fe(SCN)]2+;②[Fe(SCN)2]+;③Fe(SCN)3;④[Fe(SCN)4]-;⑤[Fe(SCN)5]2-;⑥[Fe(SCN)6]3-
(5)丙的基态原子电子排布式为

回答以下问题:
(1)G的电子式:


[Cu(NH3)4]Cl2
[Cu(NH3)4]Cl2
.(2)甲与同周期的金属元素相比,第一电离能由小到大的顺序是
Na<Al<Mg
Na<Al<Mg
(用元素符号表示).(3)完成反应方程式
反应①中,E和G的物质的量之比为2:1:
3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl
3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl
;反应②的离子方程式:
3AlO2-+Al3++6H2O=4Al(OH)3↓
3AlO2-+Al3++6H2O=4Al(OH)3↓
.(4)乙的高价阳离子的最高能级电子排布图为:


③④
③④
(选填序号),其物质的量之比为3:2
3:2
.①[Fe(SCN)]2+;②[Fe(SCN)2]+;③Fe(SCN)3;④[Fe(SCN)4]-;⑤[Fe(SCN)5]2-;⑥[Fe(SCN)6]3-
(5)丙的基态原子电子排布式为
1s22s22p63s23p63d104s1或[Ar]3d104s1
1s22s22p63s23p63d104s1或[Ar]3d104s1
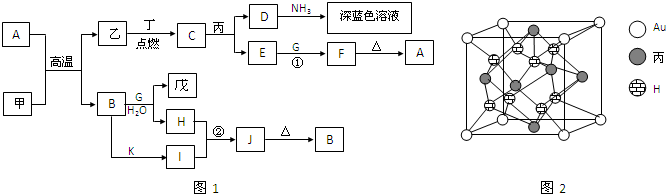
.丙与金形成的一种合金晶体具有立方最密堆积的结构,这种晶体具有储氢功能,氢原子可进入到由丙原子与Au原子构成的四面体空隙中.其晶胞结构如图2所示.这种合金晶体储氢后的化学式应为AuCu3H8
AuCu3H8
.分析:A和甲在高温下发生置换反应,且有金属单质参加和生成,应为铝热反应,则甲为Al,乙为Fe,F是红褐色沉淀,应为Fe(OH)3,则A为Fe2O3,G是淡黄色固体粉末,应为Na2O2,则B为Al2O3,戊为O2,H为NaAlO2,乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1,则丙为Cu,丁应为Cl2,C为FeCl3,D为CuCl2,E为FeCl2,K是丁的气态氢化物,应为HCl,则I为AlCl3,J为Al(OH)3,结合对应单质、化合物的性质以及元素周期律的递变规律可解答该题.
解答:解:和甲在高温下发生置换反应,且有金属单质参加和生成,应为铝热反应,则甲为Al,乙为Fe,F是红褐色沉淀,应为Fe(OH)3,则A为Fe2O3,G是淡黄色固体粉末,应为Na2O2,则B为Al2O3,戊为O2,H为NaAlO2,乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1,则丙为Cu,丁应为Cl2,C为FeCl3,D为CuCl2,E为FeCl2,K是丁的气态氢化物,应为HCl,则I为AlCl3,J为Al(OH)3,
(1)由以上分析可知G为Na2O2,为离子化合物,电子式为 ,D为CuCl2,可与氨气发生络合反应生成[Cu(NH3)4]Cl2,溶液呈深蓝色,
,D为CuCl2,可与氨气发生络合反应生成[Cu(NH3)4]Cl2,溶液呈深蓝色,
故答案为: ;[Cu(NH3)4]Cl2;
;[Cu(NH3)4]Cl2;
(2)同周期元素从左到右第一电离能逐渐增大,由于Mg最外层为2个电子,达到稳定结构,难以失去电子,则第一电离能最大,则有Na<Al<Mg,故答案为:Na<Al<Mg;
(3)①E为FeCl2,G为Na2O2,二者按照2:1反应的方程式为3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl,
故答案为:3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl;
②反应②为AlO2-和Al3+的互促水解反应,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
(4)乙为Fe,价层电子排布为3d64s2,高价阳离子为Fe3+,最高能级电子为3d5,排布图为 ,C为FeCl3,在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,二者物质的量之比为1:3.4,生成Fe(SCN)3和[Fe(SCN)4]-,设Fe(SCN)3为xmol,[Fe(SCN)4]-为ymol,则有
,C为FeCl3,在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,二者物质的量之比为1:3.4,生成Fe(SCN)3和[Fe(SCN)4]-,设Fe(SCN)3为xmol,[Fe(SCN)4]-为ymol,则有
,解之得x:y=0.006:0.004=3:2,
故答案为: ;③④;3:2;
;③④;3:2;
(5)丙为Cu,基态原子电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,由图2可知,晶胞中Au位于顶点,为8×
=1,Cu位于面心,为6×
=3,H位于体内,为8,则化学式为AuCu3H8,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;AuCu3H8.
(1)由以上分析可知G为Na2O2,为离子化合物,电子式为
 ,D为CuCl2,可与氨气发生络合反应生成[Cu(NH3)4]Cl2,溶液呈深蓝色,
,D为CuCl2,可与氨气发生络合反应生成[Cu(NH3)4]Cl2,溶液呈深蓝色,故答案为:
 ;[Cu(NH3)4]Cl2;
;[Cu(NH3)4]Cl2;(2)同周期元素从左到右第一电离能逐渐增大,由于Mg最外层为2个电子,达到稳定结构,难以失去电子,则第一电离能最大,则有Na<Al<Mg,故答案为:Na<Al<Mg;
(3)①E为FeCl2,G为Na2O2,二者按照2:1反应的方程式为3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl,
故答案为:3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl;
②反应②为AlO2-和Al3+的互促水解反应,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
(4)乙为Fe,价层电子排布为3d64s2,高价阳离子为Fe3+,最高能级电子为3d5,排布图为
 ,C为FeCl3,在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,二者物质的量之比为1:3.4,生成Fe(SCN)3和[Fe(SCN)4]-,设Fe(SCN)3为xmol,[Fe(SCN)4]-为ymol,则有
,C为FeCl3,在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,二者物质的量之比为1:3.4,生成Fe(SCN)3和[Fe(SCN)4]-,设Fe(SCN)3为xmol,[Fe(SCN)4]-为ymol,则有
|
故答案为:
 ;③④;3:2;
;③④;3:2;(5)丙为Cu,基态原子电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,由图2可知,晶胞中Au位于顶点,为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;AuCu3H8.
点评:本题考查无机物的推断,题目比较综合,难度较大,本题在解答时注意根据题给信息正确推断物质的种类为解答该题的关键,答题时注意把握题给信息,正确处理物质反应之间的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目