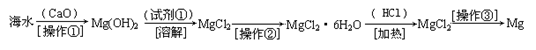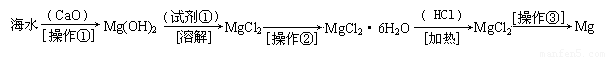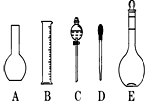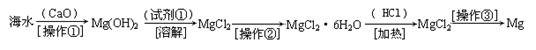题目内容
实验室中有6瓶失去标签的白色固体:纯碱、氢氧化镁、氯化钡、硫酸铝、硫酸氢钠、氯化钾.除蒸馏水、试管和胶头滴管外,无其它任何试剂和仪器.某学生通过以下实验步骤即可鉴别它们.请填写下列空白:
(1)各取适量固体于6支试管中,分别加入适量蒸馏水,有一支试管中的现象和其他5支明显不同,此支试管中的现象是________,据此现象检出的一种物质是________;
(2)分别将所剩5种溶液依次编号为A、B、C、D、E,然后进行两两混合.观察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出.据此可推断出:
①A、C、D三物质的化学式依次是________;
②B、E两者中有一种可与A反应,它与足量A反应的离子方程式为:________;
③在两两混合时,能最终确定B、E成份的实验现象及结论是:________;
(3)上述物质溶于水抑制水的电离,且溶液显酸性的物质的化学式及其溶液显酸性的原因是________.
解析:
|
(1)这支试管中的物质不溶于水;(1分) Mg(OH)2(1分) (2)①NaHSO4、KCl、BaCl2(3分) ②CO32-+2H+=H2O+CO2↑(1分) ③在B、E两溶液中,与A混合时产生气体的是纯碱,否则是硫酸铝(1分) (3)NaHSO4;原因是:NaHSO4=Na++H++SO42-,所产生的氢离子抑制水的电离.(1分) |

(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
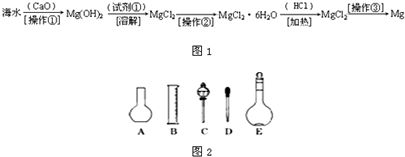
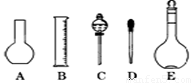
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
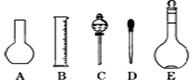
(三)(8分)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; | B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; | D.称量碳酸钠晶体时所用砝码生锈; |