��Ŀ����
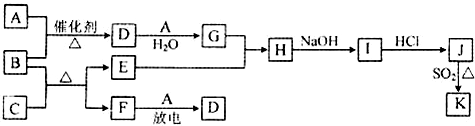
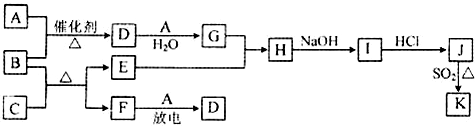
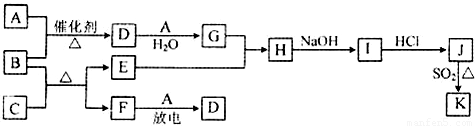
��ʾ��ͼ�漰������������Ԫ���У���һ��Ԫ���⣬�����ΪԪ�����ڱ���ǰ18��Ԫ�أ�����A��FΪ��ɫ���嵥�ʣ�BΪ���д̼�����ζ�����壬CΪ��ɫ�����EΪ��ɫ�������ʣ����ַ�Ӧ�IJ���δ�г�����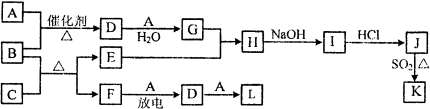
��ش��������⣺
��1��B�ĵ���ʽΪ ��
��2��J��K��ͬ�ֽ����IJ�ͬ�Ȼ��KΪ��ɫ������д��SO2��ԭJ����K�����ӷ���ʽ�� ��
��3������B�ڴ�A��ȼ�գ�������F��ˮ����ѧ�����ô�ԭ������Ƴ�B-Aȼ�ϵ�أ���ͨ������B��һ���� ����������������������������£��ü��ĵ缫��ӦʽΪ ��
��4����80��ʱ����0.80mol����L����2L�Ѿ���յĹ̶��ݻ����ܱ������з�����Ӧ����M����һ��ʱ��Ը������ڵ����ʽ��з������õ�������ݣ�
�ټ���a= �����¶�ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
�ڸı�����ʹ��Ӧ���´ﵽƽ�⣬��ʹc��M��/c��L��ֵ��С�Ĵ�ʩ�У�����ĸ��ţ� ��
A������L����ʼŨ�� B�������¶�
C��ʹ�ø�Ч���� D������������ͨ��ϡ�����壮

��ش��������⣺
��1��B�ĵ���ʽΪ
��2��J��K��ͬ�ֽ����IJ�ͬ�Ȼ��KΪ��ɫ������д��SO2��ԭJ����K�����ӷ���ʽ��
��3������B�ڴ�A��ȼ�գ�������F��ˮ����ѧ�����ô�ԭ������Ƴ�B-Aȼ�ϵ�أ���ͨ������B��һ����
��4����80��ʱ����0.80mol����L����2L�Ѿ���յĹ̶��ݻ����ܱ������з�����Ӧ����M����һ��ʱ��Ը������ڵ����ʽ��з������õ�������ݣ�
| ʱ��/s | 0 | 30 | 60 | 90 |
| n��L��/mol | 0.80 | a | b | c |
| n��M��/mol | 0.00 | 0.10 | 0.20 | 0.20 |
�ڸı�����ʹ��Ӧ���´ﵽƽ�⣬��ʹc��M��/c��L��ֵ��С�Ĵ�ʩ�У�����ĸ��ţ�
A������L����ʼŨ�� B�������¶�
C��ʹ�ø�Ч���� D������������ͨ��ϡ�����壮
������EΪ��ɫ�������ʣ�ӦΪCu����CΪCuO��BΪ���д̼�����ζ�����壬ӦΪNH3������CuO���ڼ��������·���������ԭ��Ӧ���ɵ���Cu�����ɵ����嵥��FΪN2�����������ڷŵ������·�Ӧ����NO����AΪO2��DΪNO��LΪNO2��GΪHNO3��HΪCu��NO3��2��IΪCu��OH��2��JΪCuCl2��J��K��ͬ�ֽ����IJ�ͬ�Ȼ��KΪ��ɫ������ӦΪCuCl����϶�Ӧ���ʵ����ʽ����⣮
����⣺EΪ��ɫ�������ʣ�ӦΪCu����CΪCuO��BΪ���д̼�����ζ�����壬ӦΪNH3������CuO���ڼ��������·���������ԭ��Ӧ���ɵ���Cu�����ɵ����嵥��FΪN2�����������ڷŵ������·�Ӧ����NO����AΪO2��DΪNO��LΪNO2��GΪHNO3��HΪCu��NO3��2��IΪCu��OH��2��JΪCuCl2��J��K��ͬ�ֽ����IJ�ͬ�Ȼ��KΪ��ɫ������
ӦΪCuCl��
��1��BΪNH3��Ϊ���ۻ��������ʽΪ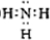 ��
��
�ʴ�Ϊ��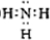 ��
��
��2��SO2��ԭCuCl2����CuCl�����ӷ���ʽΪ2Cu2++2Cl-+SO2+2H2O�T2CuCl��+4H++SO42-��
�ʴ�Ϊ��2Cu2++2Cl-+SO2+2H2O�T2CuCl��+4H++SO42-��
��3��BΪNH3���������γ�ԭ��أ��������������ɵ�����ӦΪԭ��ظ�����Ӧ�����������£��õ缫������Ӧ�ĵ缫��ӦʽΪ2NH3-6e-+6OH-��N2+6H2O��
�ʴ�Ϊ��������2NH3-6e-+6OH-��N2+6H2O��
��4����LΪNO2���������·�Ӧ��2NO2?N2O4������0.10molN2O4������0.20molNO2����a=0.80mol-0.20mol=0.60mol��
�ﵽ60sʱ������0.20molN2O4����b=0.80mol-0.40mol=0.40mol��
ƽ��ʱc��N2O4��=0.1mol/L��c��NO2��=0.20mol/L��
��ƽ�ⳣ��ΪK=
=2.5��
�ʴ�Ϊ��0.60��2.5��
�ڸı�����ʹ��Ӧ���´ﵽƽ�⣬��ʹc��M��/c��L��ֵ��С��Ӧʹƽ�����淴Ӧ�����ƶ�����÷�Ӧ������ӦΪ���ȷ�Ӧ����������¶ȣ�������L����ʼŨ�ȣ�ƽ��������Ӧ�����ƶ���������ƽ���ƶ�û��Ӱ�죬����ϡ�����壬��������䣬��Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
�ʴ�Ϊ��B��
ӦΪCuCl��
��1��BΪNH3��Ϊ���ۻ��������ʽΪ
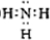 ��
���ʴ�Ϊ��
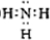 ��
����2��SO2��ԭCuCl2����CuCl�����ӷ���ʽΪ2Cu2++2Cl-+SO2+2H2O�T2CuCl��+4H++SO42-��
�ʴ�Ϊ��2Cu2++2Cl-+SO2+2H2O�T2CuCl��+4H++SO42-��
��3��BΪNH3���������γ�ԭ��أ��������������ɵ�����ӦΪԭ��ظ�����Ӧ�����������£��õ缫������Ӧ�ĵ缫��ӦʽΪ2NH3-6e-+6OH-��N2+6H2O��
�ʴ�Ϊ��������2NH3-6e-+6OH-��N2+6H2O��
��4����LΪNO2���������·�Ӧ��2NO2?N2O4������0.10molN2O4������0.20molNO2����a=0.80mol-0.20mol=0.60mol��
�ﵽ60sʱ������0.20molN2O4����b=0.80mol-0.40mol=0.40mol��
ƽ��ʱc��N2O4��=0.1mol/L��c��NO2��=0.20mol/L��
��ƽ�ⳣ��ΪK=
| 0.1 |
| 0��22 |
�ʴ�Ϊ��0.60��2.5��
�ڸı�����ʹ��Ӧ���´ﵽƽ�⣬��ʹc��M��/c��L��ֵ��С��Ӧʹƽ�����淴Ӧ�����ƶ�����÷�Ӧ������ӦΪ���ȷ�Ӧ����������¶ȣ�������L����ʼŨ�ȣ�ƽ��������Ӧ�����ƶ���������ƽ���ƶ�û��Ӱ�죬����ϡ�����壬��������䣬��Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
�ʴ�Ϊ��B��
���������⿼��������ƶϣ�Ϊ�߿��������ͣ�������ѧ���ķ����������ƶ��������ۺ�����Ԫ�ػ�����֪ʶ��ע����������Ϣ���ҳ��ƶϵ�ͻ�ƿڣ�����������ʵ������Լ����ӷ���ʽ����ѧ����ʽ����д��ע�����ƽ���ƶ��ļ��㣬�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
�����Ŀ
 ��2010?������ģ�����п�ͼ���漰����������ѧ��ѧ�����ģ����ת����ϵ��ͼ��ʾ����֪������A�ڵ���G����ȼ�գ����������ˮ��L�����嵥C������B��ȼ�գ�A��B��Gͨ��Ϊ��̬���ʣ���ش��й����⣺
��2010?������ģ�����п�ͼ���漰����������ѧ��ѧ�����ģ����ת����ϵ��ͼ��ʾ����֪������A�ڵ���G����ȼ�գ����������ˮ��L�����嵥C������B��ȼ�գ�A��B��Gͨ��Ϊ��̬���ʣ���ش��й����⣺