题目内容
【题目】请回答下列问题:
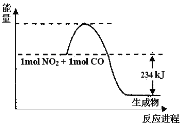
Ⅰ.如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式:______
Ⅱ.现有①BaCl2②水晶③金属铝④Na2SO4⑤冰⑥碘片六种物质,按下列要求回答(填编号,下同):
(1)熔化时不需要破坏化学键的是_______,熔化时需要破坏共价键的是_______,能导电的是______。
(2)属于离子化合物的是________,只有离子键的物质是________,属于共价化合物的是______。
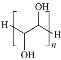
(3)①的电子式是________;⑤的结构式是________,⑤的空间构型是______,⑤中分子间作用力除了范德华力外,还含有______,因此而引起一些特殊的性质,请举出一种:______。
【答案】NO2(g)+CO(g)=CO2(g)+NO(g) H=-234kJ·mol-1 ⑤ ② ③ ①④⑥ ① ②⑤ ![]() H-O-H V形 氢键 冰的密度比水小。
H-O-H V形 氢键 冰的密度比水小。
【解析】
①BaCl2属于离子晶体,只含离子键;②水晶主要成分是SiO2属于原子晶体,只含共价键;③金属铝属于金属晶体;④Na2SO4属于离子晶体,含有离子键和共价键;⑤冰为H2O属于分子晶体,只含共价键;⑥碘片主要成分是KI属于离子晶体,只含离子键。
I.反应物的能量比生成物的能量高234KJ,则该反应为放热反应,H=-234kJ·mol-1,配平化学方程式并标注物质的状态,即得热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g) H=-234kJ·mol-1;
II.(1)分子晶体熔化时破坏分子间作用力,不破坏化学键,属于分子晶体的有⑤冰;熔化时需要破坏共价键的是原子晶体②水晶;能导电的是金属单质③铝;
(2) 属于离子化合物的是BaCl2 、Na2SO4、碘片KI;即①④⑥;只有离子键的物质是①BaCl2,属于共价化合物的是水晶SiO2、冰H2O,即②⑤;
(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合,氯化钡的电子式为![]() ;冰H2O属于分子晶体,H原子和O原子之间以共价键结合,结构式为H-O-H,冰H2O中心原子O的孤对电子数为
;冰H2O属于分子晶体,H原子和O原子之间以共价键结合,结构式为H-O-H,冰H2O中心原子O的孤对电子数为![]() ,价层电子数为2+2=4,分子构型为V形;冰H2O分子间还有氢键
,价层电子数为2+2=4,分子构型为V形;冰H2O分子间还有氢键![]() ,当分子间形成氢键时,物质的熔沸点将升高;水结成冰时,体积膨胀,密度减小,即冰的密度比水小。
,当分子间形成氢键时,物质的熔沸点将升高;水结成冰时,体积膨胀,密度减小,即冰的密度比水小。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】下表为元素周期表的一部分,用请化学用语回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)C和H的元素符号是______和_______;
(2)表中A与F的氢化物反应的化学方程式___________,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式___________;最不活泼的元素________(填写元素符号)
(3)表中所列元素中最高价氧化物对应水化物碱性最强的是___________,酸性最强的是______ (填写化学式)
(4)表中能形成两性氢氧化物的元素是__________(填写元素符号),写出该元素的氢氧化物与A的最高价氧化物对应水化物反应的离子方程式__________________。