题目内容
36g碳不完全燃烧所得气体中,CO占三分之一体积,CO2占三分之二体积.已知:
2C(s)+O2(g)═2CO(g)△H=-110.5kJ/mol,
2CO(g)+O2(g)═2CO2(g)△H=-576kJ/mol,
与这些碳完全燃烧相比,损失的热量是( )
2C(s)+O2(g)═2CO(g)△H=-110.5kJ/mol,
2CO(g)+O2(g)═2CO2(g)△H=-576kJ/mol,
与这些碳完全燃烧相比,损失的热量是( )
| A.172.5kJ | B.1149kJ | C.283kJ | D.517.5kJ |
36g碳的物质的量为n=
=
=3mol,
不完全燃烧所得气体中,CO占三分之一体积,根据碳原子守恒,求得CO的物质的量为3mol×
=1mol,
根据2CO(g)+O2(g)═2CO2(g)△H=-576kJ/mol,
1molCO燃烧放出的热量为576kJ×
=283kJ.
所以36g碳不完全燃烧生成1molCO损失的热量为283kJ,
故选:C.
| m |
| M |
| 36g |
| 12g/mol |
不完全燃烧所得气体中,CO占三分之一体积,根据碳原子守恒,求得CO的物质的量为3mol×
| 1 |
| 3 |
根据2CO(g)+O2(g)═2CO2(g)△H=-576kJ/mol,
1molCO燃烧放出的热量为576kJ×
| 1 |
| 2 |
所以36g碳不完全燃烧生成1molCO损失的热量为283kJ,
故选:C.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目


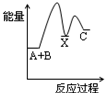
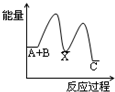
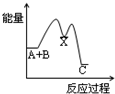
 2Z(g)
2Z(g)