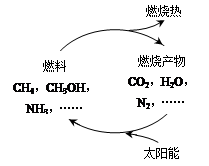
题目内容
已知下列四个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H1; 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2;
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H3; 2H2S(g)+O2(g)=2S(s)+2H2O(l) △H4;
则△H四者的关系中正确的是
| A.△H1>△H2>△H3>△H4 | B.△H4>△H2>△H3>△H1 |
| C.△H3>△H4>△H1>△H2 | D.△H4>△H3>△H2>△H1 |
C
解析试题分析:H2S完全燃烧生成液体水时放出的热量最多,但放热越多,△H越小,因此最小△H2,其次是△H1;H2S不完全燃烧放出的热量少,其中生成气态水放热最少,所以△H3最大,其次是△H3,因此△H四者的关系中正确的是△H3>△H4>△H1>△H2,答案选C。
考点:考查反应热大小比较的判断

练习册系列答案
相关题目
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化但不一定有能量变化 |
B.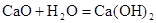 是放热反应,说明CaO的能量大于 是放热反应,说明CaO的能量大于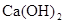 的能量 的能量 |
C.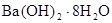 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
下列反应属于吸热反应的是
| A.葡萄糖在人体内氧化分解 | B.氢气在氧气中燃烧 |
| C.氢氧化钡晶体与氯化铵晶体反应 | D.氢氧化钾和硫酸中和 |
已知反应 ①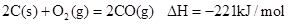
②稀溶液中,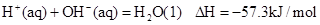 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2  2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是