题目内容
归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
性质\元素 | 8O | 16S | 34Se | 52Te |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是_________
(2)碲的化合价可能有_________
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是_________ (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
A12Te3 + ( ) A1(OH)3↓ + H2Te↑
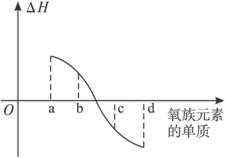
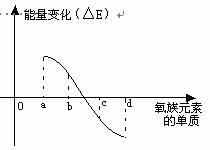
(6)右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
(1)113 ~ 450℃;
(2)-2、+4、+6;
(3)H2Te>H2Se>H2S;
(4)还原性; 2H2Se + O2 == 2H2O + 2Se;
(5)A12Te3 + ( 6H2O) ![]() 2A1(OH)3↓ +3H2Te↑
2A1(OH)3↓ +3H2Te↑
(6)硫; 碲;

练习册系列答案
相关题目
(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃ | —218。4 | 113 | | 450 |
| 单质沸点(℃) | —183 | 444.6 | 685 | 1390 |
| 主要化合价 | —2 | —2,+4,+6 | —2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)晶体硫属于 晶体,硒的焙点T的范围可能是 。
(2)碲的化合价可能有 。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(5)工业上Al2Te3可用来制各H2Te,完成下列化学方程式:
Al2Te3+ ( )一 A1(OH)3↓+ H2Te↑
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).