题目内容
合成氨反应:N2(g)+3H2(g) 2NH3(g) DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是
2NH3(g) DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是

 2NH3(g) DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是
2NH3(g) DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是
| A.t1时升高了温度 | B.t2时增大了压强 |
| C.t3时减小了NH3的浓度 | D.t4时降低了温度 |
D
A 错误,t1时可能升高了温度,也可能增大了压强。
B 错误,t2时使用了催化剂,平衡不移动。
C 错误,t3时减小了N2或者H2的浓度,平衡左移。
D 正确,t4时降低了温度,反应速率突然降低,平衡右移,V正>V逆
B 错误,t2时使用了催化剂,平衡不移动。
C 错误,t3时减小了N2或者H2的浓度,平衡左移。
D 正确,t4时降低了温度,反应速率突然降低,平衡右移,V正>V逆

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。 2AB3(g),下列情况一定能说明该可逆反应已经达到化学平衡状态的是
2AB3(g),下列情况一定能说明该可逆反应已经达到化学平衡状态的是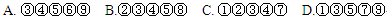
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是 2HI(g),下列情况一定能说明反应已达到限度的是
2HI(g),下列情况一定能说明反应已达到限度的是 ⑴合成氨反应反应:N2(g)+3H2(g)
⑴合成氨反应反应:N2(g)+3H2(g) 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。 2C B. A+B
2C B. A+B 2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )
2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )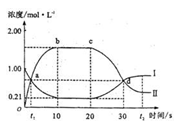
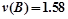 mol/(L·s)
mol/(L·s)