题目内容
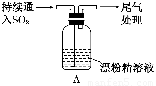
某学生对SO2与漂粉精的反应进行实验探究:
|
操作 |
现象 |
|
取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
|
|
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(1)2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O。
(2)漂白性。
(3)①检验氯气。②SO2也能和酸化的硝酸银生成白沉。
(4)要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可。
(5)①CaSO4。②Cl2+SO2+2H2O===2Cl-+4H++ SO42-。
【解析】(1)考查氯气与石灰乳的反应,基础方程式2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O(2)漂粉精中ClO-水解显碱性、同时具有漂白性(3)用湿润的淀粉碘化钾试纸可以检验氯气,不能说明白雾为HCl的原因为:SO2也能和酸化的硝酸银生成白沉(4)要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可(5)X为CaSO4黄色褪去的方程式也为基础方程式Cl2+SO2+2H2O=2Cl-+4H++ SO42-
(1)C12和Ca(OH)2制取漂粉精的化学方程是2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是漂白性。
(3)① 实验a目的是检验氯气。
②由实验a、b不能判断白雾中含有HC1,理由是SO2也能和酸化的硝酸银生成白沉。
(4)要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可。
(5)①CaSO4。②Cl2+SO2+2H2O===2Cl-+4H++ SO42-。
【考点定位】本题以非金属化合物的性质为载体考查综合实验。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
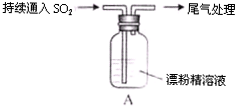 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:a.用湿润的碘化钾淀粉试纸检验白雾,无变化;b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是
②由实验a、b不能判断白雾中含有HC1,理由是
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应.通过进一步实验确认了这种可能性,其实验方案是
(5)将A瓶中混合物过滤、洗涤,得到沉淀X.向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色;iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是______________________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象iii中黄绿色褪去的原因:_____________________________________________________________________。