题目内容
某学生对SO2与漂粉精的反应进行实验探究:| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
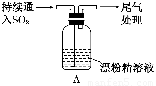
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:a.用湿润的碘化钾淀粉试纸检验白雾,无变化;b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是
②由实验a、b不能判断白雾中含有HC1,理由是
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应.通过进一步实验确认了这种可能性,其实验方案是
(5)将A瓶中混合物过滤、洗涤,得到沉淀X.向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是
(2)pH试纸先变蓝(约为12),后褪色说明溶液呈碱性,具有漂白性;
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)依据次氯酸根离子和氯离子在酸溶液中会发生归中反应生成氯气,向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)二氧化硫通入漂白精溶液中,形成酸溶液,次氯酸根离子具有强氧化性可以氧化二氧化硫为硫酸和钙离子形成硫酸钙沉淀;二氧化硫继续通入后和生成的氯气发生反应生成硫酸和盐酸.
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)pH试纸先变蓝(约为12)溶液呈碱性,后褪色溶液具有漂白性,所以说明溶液呈碱性,具有漂白性;
故答案为:碱性、漂白性;
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,
①用湿润的碘化钾淀粉试纸检验白雾,无变化;为了检验白雾中是否含有氯气,因为含有氯气在检验氯化氢存在时产生干扰;
故答案为:检验白雾中是否含有Cl2,排除Cl2干扰;
②用酸化的AgNO3溶液检验白雾,产生白色沉淀,若含有二氧化硫气体,通入硝酸酸化的硝酸银溶液,会被硝酸氧化为硫酸,硫酸和硝酸银反应也可以生成硫酸银沉淀,所以通过实验不能证明一定含有氯化氢,
故答案为:白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,漂白精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,
故答案为:向漂白精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(5))取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4,故答案为:CaSO4.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
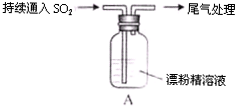
|
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色;iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是______________________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象iii中黄绿色褪去的原因:_____________________________________________________________________。
某学生对SO2与漂粉精的反应进行实验探究:
|
操作 |
现象 |
|
取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
|
|
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。