题目内容
(4分)将4.42 g复盐CuSO4·x(NH4)2SO4·y H2O加到过量NaOH溶液中,加热,生成的气体用100 mL 1 mol·L-1H2SO4吸收,多余的H2SO4用80 mL 2 mol·L-1NaOH恰好完全中和,另取等质量的复盐溶于水后与足量BaCl2溶液反应,生成6.99 g沉淀,求x、y的值。
x=2,y=1。
n(BaSO4)="0.03" mol,n(H+)="0.2" mol,与NH3反应的H+的物质的量为:0.2 mol-0.08 L×2 mol·L-1="0.04" mol n(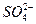 )="0.03" mol;
)="0.03" mol;
所以n (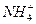 ): n (
): n (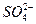 )=0.04∶0.03=4∶3 2x∶(x+1)=4∶3 x=2
)=0.04∶0.03=4∶3 2x∶(x+1)=4∶3 x=2
又因为:M(复盐)="4.42" g÷0.01 mol="442" g·mol-1,所以y=1。
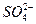 )="0.03" mol;
)="0.03" mol;所以n (
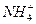 ): n (
): n (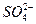 )=0.04∶0.03=4∶3 2x∶(x+1)=4∶3 x=2
)=0.04∶0.03=4∶3 2x∶(x+1)=4∶3 x=2又因为:M(复盐)="4.42" g÷0.01 mol="442" g·mol-1,所以y=1。

练习册系列答案
相关题目
 (1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。
(1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。