��Ŀ����
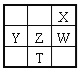
����Ŀ�����±�ΪԪ�����ڱ���һ���֣�����X��Y��Z��WΪ������Ԫ�أ�WԪ�صĺ˵����ΪXԪ�ص�2��������˵����ȷ���ǣ� ��
A. X��W��ZԪ�ص�ԭ�Ӱ뾶�����ǵ���̬�⻯������ȶ��Ծ����ε���
B. Y��Z��WԪ������Ȼ���о�����������̬���ڣ����ǵ�����������ˮ������������ε���
C. ����Ԫ�������ɣ������Ʋ�TԪ�صĵ��ʾ��а뵼�����ԣ�T2X3���������Ժͻ�ԭ��
D. YX2�����ۻ���Һ̬WX3��������˷����Ӽ�������
���𰸡�C
�����������������X��Y��Z��WΪ������Ԫ�أ���Ԫ�����ڱ���֪��XӦλ�ڵڶ����ڣ���Ӧ�������ڱ����Ұ벿�֣�W��X����ͬһ���壬��WԪ��ԭ�ӵĺ˵����ΪXԪ�ص�2������ôXΪO��WΪS����ôZΪP��TΪAs��YΪSi��A��Ԫ�صķǽ�����Խǿ������̬�⻯��Խ�ȶ������ڷǽ�����O��S��P����H2O��H2S��H3P��A����B��SԪ������Ȼ���д�������̬���ʣ����ڻ�ɽ�ڸ�����B����C��As����Ԫ�����ڱ��Ľ�����ǽ����ֽ����ϣ����а뵼������ܣ�T2X3ΪAs2O3��As�Ļ��ϼ�Ϊ+3�������м�ۣ��ʼ���������Ҳ�л�ԭ�ԣ�C��ȷ��D��YX2ΪSiO2������ԭ�Ӿ��壬�ù����ۻ��˷����ǹ��ۼ���û�з��Ӽ���������D����ѡC��

����Ŀ��ú�������Ƕ�ú������ӹ�����Ҫ����������Ҫ��Ӧ��̼��ˮ������Ӧ����ˮú����
��1����֪��101KPa��150��ʱ����1mol��̼��һ����̼���������������������ȼ�ղ��ָ���ԭ�¶ȣ����ų��������ֱ�Ϊ393.7kJ/mol��283.0kJ/mol��242.0 kJ/mol����д��ú��������Ӧ���Ȼ�ѧ����ʽ__________________���������ѧ�Ƕȼ����÷�Ӧ��ij�������ܹ�������е�ԭ����_______________��
��2���ں����ܱ�����������ʵ�����1:1����һ������̼��ˮ������Ӧ����ˮú����һ�������´ﵽƽ�⣬���ı䷴Ӧ��ijһ����ʱ�����б仯��˵��ƽ��һ��������Ӧ�����ƶ�����_________��������ţ�
A.����Ӧ�������������� B.��ѧƽ�ⳣ��K����
C.��������ƽ����Է����������� D.��Ӧ�����������������
��3��һ��������ú���������ﻹ���Է�����Ӧ��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������CO��H2O��������Ӧ��CO(g)+H2O(g)![]() CO2(g)+ H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±���
CO2(g)+ H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
����ݱ���ش��������⣺
�ټ��㷴Ӧ��5min����������ʾ��ƽ������Ϊ��_____________��
����ʽ������÷�Ӧ��700��ʱ�Ļ�ѧƽ�ⳣ��K=__________������¶�����800�棬������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ___________������ȡ����ȡ�����Ӧ��
�۽��ϱ��д�ƽ���Ļ������ָ������£���200mL2mol/LNaOH��Һ�������գ���ַ�Ӧ�������Һ������䣬����˵������ȷ���ǣ�����֪HCO3-���볣��ԼΪ4![]() 10-11��CaCO3���ܶȻ�����ԼΪ3
10-11��CaCO3���ܶȻ�����ԼΪ3![]() 10-9��___________
10-9��___________
A.c��Na+��+c��H+��=c��OH-��+c��HCO3-��+2c��CO32-��
B.c��H2CO3����c��CO32-��
C.c��Na+��+c��OH-��=c��H+��+c��HCO3-��+2c��H2CO3��
D.�����Һ�м���������Ũ�ȵ�CaCl2��Һ������ɫ����

