题目内容
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是____________________________
②属于分解反应,但不是氧化还原反应的是__________________________
③属于化合反应,但不是氧化还原反应的是__________________________
④不属于四种基本反应类型的氧化还原反应的是______________________
A.(NH4)2SO3  2NH3↑+H2O+SO2↑ 2NH3↑+H2O+SO2↑ |
| B.2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O |
C.2C+SiO2  Si+2CO↑ Si+2CO↑ |
D.NH4NO3  N2O↑+2H2O N2O↑+2H2O |
F.MnO2+4HCl(浓)
 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O(2)对于反应:K2Cr2O7+HCl → KCl+CrCl3+Cl2↑+H2O,回答下列问题:
①配平方程式,并用单线桥表示此反应转移的电子数目及方向
____K2Cr2O7+____HCl ="____KCl" +____ CrCl3+____Cl2↑+____H2O
②若反应中,发生氧化反应的HCl为1.2 mol,则被还原的K2Cr2O7 物质的量为___________mol。
(1) ① D ② A ③ E ④B、F
(2)1 14 2 2 3 7 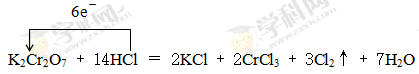 0.2
0.2
解析试题分析:(1)A、反应(NH4)2SO3  2NH3↑+H2O+SO2↑属于分解反应,元素的化合价均不变,因此不是氧化还原反应;B、反应2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O中Mn和Cl元素的化合价分别由+7价降低到+2价、-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型;C、反应2C+SiO2
2NH3↑+H2O+SO2↑属于分解反应,元素的化合价均不变,因此不是氧化还原反应;B、反应2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O中Mn和Cl元素的化合价分别由+7价降低到+2价、-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型;C、反应2C+SiO2  Si+2CO↑是置换反应,碳元素的化合价由0价升高到+2价,Si元素的化合价从+4价降低到0价,因此也是氧化还原反应;D、反应NH4NO3
Si+2CO↑是置换反应,碳元素的化合价由0价升高到+2价,Si元素的化合价从+4价降低到0价,因此也是氧化还原反应;D、反应NH4NO3  N2O↑+2H2O中NH4+中氮元素的化合价从-3价升高到+1价,NO3-中氮元素的化合价从+5价降低到+1价,因此是氧化还原反应,同时也是分解反应;E、反应Na2CO3+CO2+ H2O=2NaHCO3中元素的化合价均不变,不是氧化还原反应,属于化合反应;F、反应MnO2+4HCl(浓)
N2O↑+2H2O中NH4+中氮元素的化合价从-3价升高到+1价,NO3-中氮元素的化合价从+5价降低到+1价,因此是氧化还原反应,同时也是分解反应;E、反应Na2CO3+CO2+ H2O=2NaHCO3中元素的化合价均不变,不是氧化还原反应,属于化合反应;F、反应MnO2+4HCl(浓) MnCl2+Cl2↑+ 2H2O中Mn元素的化合价从+4价降低到+2价,氯元素的化合价从-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型。则
MnCl2+Cl2↑+ 2H2O中Mn元素的化合价从+4价降低到+2价,氯元素的化合价从-1价升高到0价,因此是氧化还原反应,但不属于四种基本反应类型。则
①既属于分解反应又是氧化还原反应的是D;
②属于分解反应,但不是氧化还原反应的是A;
③属于化合反应,但不是氧化还原反应的是E;
④不属于四种基本反应类型的氧化还原反应的是B、F。
(2)根据方程式K2Cr2O7+HCl → KCl+CrCl3+Cl2↑+H2O可知,反应中Cr元素的化合价从+6价降低到+3价,得到3个电子。氯元素的化合价从-1价升高到0价,因此根据电子得失守恒可知,氧化剂K2Cr2O7 与还原剂HCl的物质的量之比是1:6。根据原子守恒可知氯化钾和CrCl3前面的化学计量数分别是2和2,则氯化氢的计量数是14,所以氢气的计量数是7,则配平后的化学方程式为K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,其中用单线桥可表示为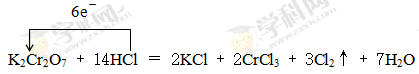 。
。
②若反应中,发生氧化反应的HCl为1.2 mol,则转移电子的物质的量是1.2mol。1molK2Cr2O7在反应中得到6mol电子,所以就电子得失守恒可知被还原的K2Cr2O7 物质的量为1.2mol÷6=0.2mol。
考点:考查氧化还原反应和四种基本反应类型的判断;氧化还原反应方程式配平和表示以及计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O