题目内容
【题目】四氯化锡(SnCl4)是一种重要的化工产品,可在加热下直接氯化来制备。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
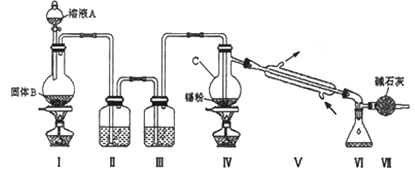
(1)装置Ⅰ中发生反应的离子方程式为________;
(2)装置Ⅱ中的最佳试剂为_______,装置Ⅶ的作用为_______;
(3)该装置存在的缺陷是:_______________;
(4)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为_______________;
(5)实验用锡粒中含有杂质Cu.某同学设计下列实验测定锡粒的纯度.
第一步:称取0.613g锡粒溶入足量盐酸中,过滤;
第二步:向滤液中加入过量FeCl3溶液,将Sn2+氧化成Sn4+;
第三步:用0.100 molL-1 K2Cr2O7溶液滴定生成的Fe2+,发生反应的表达式为(未配平):Fe2+ + Cr2O72- + H+→Cr3+ + Fe3+ + H2O
第二步中发生反应的离子方程式是 _______________,若达到滴定终点时共消耗16.0 mLK2Cr2O7溶液,试写出试样中锡的质量分数的计算式____________(仅写计算结果,锡的相对原子质量按119计算)
【答案】MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2↑ + 2H2O饱和氯化钠溶液防止空气中水蒸气进入装置,使SnCl4水解缺少尾气处理装置Sn(OH)4或SnO22Fe3+ + Sn2+ = Sn4+ + 2Fe2+93.18%
Mn2+ + Cl2↑ + 2H2O饱和氯化钠溶液防止空气中水蒸气进入装置,使SnCl4水解缺少尾气处理装置Sn(OH)4或SnO22Fe3+ + Sn2+ = Sn4+ + 2Fe2+93.18%
【解析】
由装置图可知装置Ⅰ应为制备氯气的装置,装置Ⅱ和装置Ⅲ是氯气的净化装置,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4,经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中。(5)用已知浓度的K2Cr2O7滴定生成的Fe2+,根据原子守恒、电子转移守恒可得关系式:Sn~Sn2+~2Fe3+~2Fe2+~![]() K2Cr2O7,据此分析解答。
K2Cr2O7,据此分析解答。
(1)装置Ⅰ中浓盐酸与MnO2在加热时发生反应产生氯气,发生反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)由于盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在与金属锡反应前要除去,因此装置Ⅱ中的最佳试剂为除去HCl同时还可以减少氯气消耗的饱和食盐水;SnCl4极易水解,在潮湿的空气中发烟,为了防止盐水解,所以要防止起水解,装置Ⅶ的作用为防止空气中的水蒸气进入Ⅵ中使SnCl4水解,故答案为:饱和氯化钠溶液;防止空气中水蒸气进入Ⅵ中,SnCl4水解;
(3)未反应的氯气没有除去,缺少尾气处理装置,故答案为:缺少尾气处理装置;
(4)如果没有装置Ⅲ,则在氯气中含有水蒸汽,所以在Ⅳ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物Sn(OH)4或SnO2,故答案为:Sn(OH)4或SnO2等;
(5)滴定过程中的反应方程式为6Fe2+ + Cr2O72- + 14H+=2Cr3+ + 6Fe3+ + 7H2O,第二步中加入过量FeCl3溶液,将Sn2+氧化成Sn4+,反应的方程式为2Fe3+ + Sn2+ = Sn4+ + 2Fe2+,令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~![]() K2Cr2O7
K2Cr2O7
119g ![]() mol
mol
0.613xg 0.100 molL-1×0.016L
故![]() =
=![]() ,解得x=93.18%,故答案为:93.18%。
,解得x=93.18%,故答案为:93.18%。