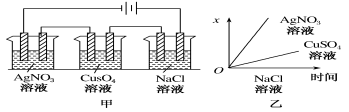
题目内容
【题目】Ⅰ.金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
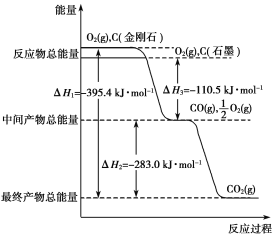
(1)等质量的金刚石和石墨完全燃烧,____________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式:_______________________。注意:石墨用“C(石墨,s)”表示。
(2)在通常状况下,____________(填“金刚石”或“石墨”)更稳定。
(3)6 g石墨在一定量空气中燃烧,生成气体18 g,该过程中放出的热量为______________kJ。
Ⅱ.白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
4P(红磷,s)+5O2(g)= 4 P4O10(s) ΔH2=-2954 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式:4P(红磷,s) ==P4(白磷,s)ΔH=____________
(2)已知298 K时白磷不完全燃烧的热化学方程式为:P4(白磷,s)+3O2(g)=P4O6(s) ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为_________________,反应过程中放出的热量为___________kJ。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):
P—P:198,Cl—Cl :243,P—Cl:331。
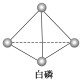
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=_______________。
【答案】
Ⅰ、(1)金刚石;C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(2)石墨(3)126
Ⅱ、(1)+29.2 kJ·mol-1
(2)3∶1;1 323.45
(3)-1 326 kJ·mol-1
【解析】
试题分析:Ⅰ、(1)图象分析可知,金刚石能量高于石墨,等量金刚石和石墨完全燃烧生成二氧化碳时金刚石放热多,石墨燃烧生成二氧化碳放热110.5KJ+283.0KJ=393.5KJ;反应的热化学方程式为:C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;故答案为:金刚石;C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;
(2)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,故答案为:石墨;
(3)6g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为22g,若生成一氧化碳质量为14g,生成气体18g,14g<18g<22g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=18g,x=0.25mol,二氧化碳物质的量为0.25mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ;C(石墨,s)+![]() O2(g)═CO(g) △H=-110.5 kJmol-1
O2(g)═CO(g) △H=-110.5 kJmol-1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJmol-1 ×0.25mol+110.5 kJmol-1 ×0.25mol=126KJ;6g石墨在一定量空气中燃烧,生成气体18g,该过程放出的热量为126.0kJ;故答案为:126.0 kJ;
Ⅱ、(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①,P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H2=-738.5kJ/mol,…②,根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷) △H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol;则4P(s,红磷)=P4(s,白磷)△H=+29.2kJ/mol;故答案为: +29.2kJ/mol;
P4O10(s) △H2=-738.5kJ/mol,…②,根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷) △H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol;则4P(s,红磷)=P4(s,白磷)△H=+29.2kJ/mol;故答案为: +29.2kJ/mol;
(2)在某密闭容器中加入62g白磷和50.4L氧气(标准状况),白磷中磷原子物质的量=![]() =2mol原子,氧气物质的量=
=2mol原子,氧气物质的量=![]() =2.25mol,含有4.5mol氧原子;依据原子守恒列式计算:设P4O10物质的量为x,P4O6物质的量为y,4x+4y=2,5x+3y=2.25,计算出x=0.375mol,y=0.125mol,最后生成0.375molP4O10,0.125molP4O6mol,故物质的量之比为3:1;P4(白磷,s)+3O2(g)═P4O6(s)△H=-1 638kJmol-1;P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJmol-1;放出的热量=0.375mol×(-2983.2KJ/mol)+0.12 mol×(-1638KJ/mol)=1323.45KJ;故答案为:3:1;1323.45KJ;
=2.25mol,含有4.5mol氧原子;依据原子守恒列式计算:设P4O10物质的量为x,P4O6物质的量为y,4x+4y=2,5x+3y=2.25,计算出x=0.375mol,y=0.125mol,最后生成0.375molP4O10,0.125molP4O6mol,故物质的量之比为3:1;P4(白磷,s)+3O2(g)═P4O6(s)△H=-1 638kJmol-1;P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJmol-1;放出的热量=0.375mol×(-2983.2KJ/mol)+0.12 mol×(-1638KJ/mol)=1323.45KJ;故答案为:3:1;1323.45KJ;
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJmol-1):P-P 198,Cl-Cl 243,P-Cl 331.则反应P4(白磷,s)+6Cl2(g)═4PCl3(s)的反应热△H=198KJ/mol×6+6×243KJ/mol-4×3×331KJ/mol=-1326KJ/mol;故答案为:-1326KJ/mol。

【题目】实验室用密度为1.25 g mL-1、质量分数为36.5%的浓盐酸配制240 mL 0.1 mol L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 。
(2)配制 240 mL 0.1 mol L-1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
(1)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL), 用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, 。
②容量瓶中原有少量蒸馏水, 。
③定容时观察液面俯视, 。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 。
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 。
③定容摇勻后发现液面下降 。