题目内容
短周期A、B、C、D、E五种主族元素,原子序数依次增大,B、C、E最外层电子数之和为11,A原子最外层电子数是次外层电子数的2倍,C是同周期中原子半径最大的元素,工业上一般通过电解氧化物的方法获得D的单质,E单质是制备太阳能电池的重要材料。下列说法正确的是
A. 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多
B. C与D的最高价氧化物对应的水化物的碱性相比,后者更强
C. 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 简单离子半径:B<C
实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是
选项 | 容量瓶容积 | 溶质质量 | 实验操作 |
A | 480mL | 硫酸铜:7.68g | 加入 500mL水 |
B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
A. A B. B C. C D. D
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
(1)已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O (l) ΔH2
③H2O (l)= H2O (g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH =________。
CO2(g)+2H2(g)的ΔH =________。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0
CH3OH(g)+H2O(g)ΔH<0
①工业生产过程中CO2和H2的转化率________(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是_______________(填两点)。
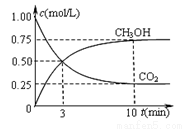
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如下图所示。该温度下的平衡常数为______(保留三位有效数字)。
改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)___K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)。
②对反应Ⅰ,前10 min内的平均反应速率υ(CH3OH)=______,若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。