题目内容
(1)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的多原子分子M、N、W,且在M、N、W分子中,A、B、C原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为_____ (用元素符号表示)。A22-与C22+互为等电子体,C22+的电子式__________
②N的沸点比其同族相邻氢化物沸点高的主要原因是_____。W分子的空间构型的名称是_________
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①F元素基态原子电子排布式为_____
②E元素单质的晶体堆积模型为_____(填字母)
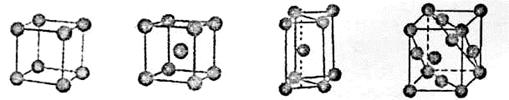
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
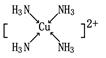
③向G的硫酸盐溶液中通入过量N气体,可生成[G(N)4]2+不考虑空间构型,[G(N)4]2+
的结构可用示意图表示为_____ (用元素符号表示)。
①A、B、C的第一电离能由小到大的顺序为_____ (用元素符号表示)。A22-与C22+互为等电子体,C22+的电子式__________
②N的沸点比其同族相邻氢化物沸点高的主要原因是_____。W分子的空间构型的名称是_________
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①F元素基态原子电子排布式为_____
②E元素单质的晶体堆积模型为_____(填字母)

a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
③向G的硫酸盐溶液中通入过量N气体,可生成[G(N)4]2+不考虑空间构型,[G(N)4]2+
的结构可用示意图表示为_____ (用元素符号表示)。
(1)①C<O<N

②氨分子间形成氢键,使熔沸点升高 V型
(2)①1s22s22p63s23p63d54s1 或 [Ar]3d54s1
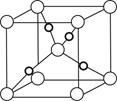
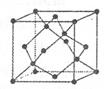
②b
③
试题分析:(1)根据题中所述元素特征,可知D为H,A为C,B为N,C为O,M为CH4,N为NH3,W为H2O。
①同周期元素第一电离能自左向右有增大的趋势,但第五主族元素因p轨道半满,第一电离能大于第六主族元素。根据C22-离子可写出O22+离子的电子式。
②NH3的沸点高是因为分子间形成了氢键。水分子的空间构型是V型。
(2)最外层电子排布是4s1的元素有K、Cr、Cu,则E为K,F为Cr,G为Cu。
①基态F原子的核外电子排布为1s22s22p63s23p63d54s1。
②金属Na晶体的晶胞为体心立方堆积。
③Cu2+可提供空轨道,NH3可提供孤电子对,二者可形成配位键。

练习册系列答案
相关题目