题目内容
在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6g 铜粉,充分反应后产生的气体在标准状况下的体积为2.24L,则x值至少为( )A.0.1
B.0.12
C.0.15
D.0.2
【答案】分析:离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,9.6g铜粉的物质的量为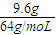 =0.15mol,反应后生成NO气体,物质的量为
=0.15mol,反应后生成NO气体,物质的量为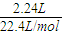 =0.1mol,根据反应的离子方程式计算需要硫酸的物质的量.
=0.1mol,根据反应的离子方程式计算需要硫酸的物质的量.
解答:解:9.6g铜粉的物质的量为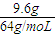 =0.15mol,反应后生成NO气体,物质的量为
=0.15mol,反应后生成NO气体,物质的量为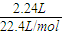 =0.1mol,
=0.1mol,
根据反应判断
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3 2 8 2
0.15mol 0.1mol (2x+0.1)mol 0.1mol
要使充分反应后产生的气体在标准状况下的体积为2.24L,则有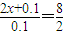 ,x=0.15,为使铜全部溶解,生成气体体积为2.24L,硫酸的物质的量最少为0.15mol,
,x=0.15,为使铜全部溶解,生成气体体积为2.24L,硫酸的物质的量最少为0.15mol,
故选C.
点评:本题考查硫酸的物质的量的计算,题目难度不大,本题注意利用离子方程式计算,并判断反应的物质的量的关系.
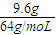 =0.15mol,反应后生成NO气体,物质的量为
=0.15mol,反应后生成NO气体,物质的量为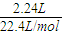 =0.1mol,根据反应的离子方程式计算需要硫酸的物质的量.
=0.1mol,根据反应的离子方程式计算需要硫酸的物质的量.解答:解:9.6g铜粉的物质的量为
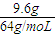 =0.15mol,反应后生成NO气体,物质的量为
=0.15mol,反应后生成NO气体,物质的量为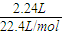 =0.1mol,
=0.1mol,根据反应判断
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3 2 8 2
0.15mol 0.1mol (2x+0.1)mol 0.1mol
要使充分反应后产生的气体在标准状况下的体积为2.24L,则有
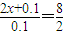 ,x=0.15,为使铜全部溶解,生成气体体积为2.24L,硫酸的物质的量最少为0.15mol,
,x=0.15,为使铜全部溶解,生成气体体积为2.24L,硫酸的物质的量最少为0.15mol,故选C.
点评:本题考查硫酸的物质的量的计算,题目难度不大,本题注意利用离子方程式计算,并判断反应的物质的量的关系.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
在某稀溶液中含有0.2mol HNO3和x mol H2SO4,向其中加入19.2g 铜粉,充分反应后产生的气体在标准状况下的体积为4.48L,则x值至少为( )
| A、0.6 | B、0.4 | C、0.3 | D、0.2 |