题目内容
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
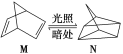
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4) 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1;CO(g)+l/2O2(g)=CO2(g)△H=-283. 0kJ mol-1;C(石墨)+O2(g)=CO2(g)△H=-393.5kJ mol-1。则4Fe (s)+3O2(g) =2Fe2O3(s)△H=____________。
【答案】M < 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)ΔH=-290 kJ·mol-1 -1641.0 kJ mol-1
【解析】
根据反应吸放热判断物质能量高低,进而判断物质的稳定性,根据盖斯定律书写热化学反应方程式并计算反应热。
(1)有机物M经过太阳光光照可转化成N:△H= +88.6kJmol-1,该过程是吸热反应,N暗处转化为M,是放热反应,根据反应物的能量越低越稳定,可知M稳定,故答案为:M;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热,故答案为:<;
(3)有1 mol Cl2参与反应时释放出145kJ热量,2 mol氯气反应放热290 kJ,反应的热化学方程式为:2Cl2(g) +2H2O(g) +C(s)═4HCl(g)+CO2(g)△H= -290 kJmol-1,故答案为:2Cl2(g) +2H2O(g)+C(s)═4HCl(g)+CO2(g)△H= -290kJmol-1 ;
(4)根据盖斯定律,将反应③×6①×2②×6得:4Fe(s)+3O2(g)![]() 2Fe2O3(s),则ΔH=393.5 kJ·mol1×6489.0 kJ·mol1×2+283.0 kJ·mol1×6=1641.0 kJ·mol1,故答案为:-1641.0 kJ mol-1。
2Fe2O3(s),则ΔH=393.5 kJ·mol1×6489.0 kJ·mol1×2+283.0 kJ·mol1×6=1641.0 kJ·mol1,故答案为:-1641.0 kJ mol-1。

【题目】电石浆是氯碱工业中的一种废弃物,其大致组成如表所示:
成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶性的物质 |
质量分数/% | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
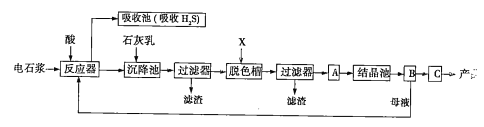
已知氯化钙晶体的化学式是CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用______________。
(2)脱色槽中应加入的物质X是__________;设备A的作用是__________;设备B的名称为__________;设备C的作用是_______________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_______(填序号)。反应的化学方程式为____________________________。
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______________________。