题目内容
【题目】如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题: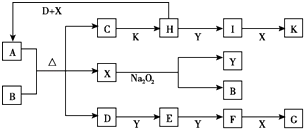
(1)写出D(少量)、H、X反应生成A的离子反应方程式: .
(2)写出D与Y反应生成E的化学方程式: .
(3)写出D与K反应生成的正盐溶液中的离子浓度大小关系: .
(4)已知:2H(g)+Y(g)2I(g)△H=﹣196.6 kJmol﹣1 . 当加入4mol H和2mol Y后,放出345 kJ的热量时,H的转化率最接近于(填字母).
A.40%
B.50%
C.80%
D.90%
【答案】
(1)NH3+SO2+H2O=NH4++HSO3﹣
(2)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(3)c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
(4)D
【解析】解:X为无色液体,与过氧化钠反应得到B与气体Y,则X是H2O,Y是O2 , B是NaOH.A能与氢氧化钠反应生成气体D,且D为10电子分子,可判断A为铵盐,D为NH3;C与强酸K反应,生成气体H,且H能与Na2O2发生化合反应,可判断H具有还原性,H的氧化产物能与Ba2+生成难溶于酸的沉淀,可知该沉淀是BaSO4 , 据此逐步推出,A为NH4HSO3 , C为Na2SO3 , H为SO2 , I为SO3 , K为硫酸;由D到G的转化过程可判断,E为NO,F为NO2 , G为HNO3 . (1)亚硫酸属于二元酸,NH3少量时生成酸式盐,反应离子方程式为:NH3+SO2+H2O=NH4++HSO3﹣ , 所以答案是:NH3+SO2+H2O=NH4++HSO3﹣;(2)NH3在催化剂存在下可被O2氧化为NO,这是工业生成硝酸的基础,反应方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:4NH3+5O2
4NO+6H2O,所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(3)NH3与硫酸反应生成(NH4)2SO4 , 铵根离子部分水解使溶液呈酸性,故溶液中的离子浓度关系为:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣),所以答案是:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣);(4)根据热化学反应方程式可知,4 mol SO2与2 mol O2完全反应放出的热量为:196 kJ×2=392 kJ,实际放出的热量为345 kJ,故SO2的转化率为:345 kJ/392 kJ=0.88,故选:D.
4NO+6H2O;(3)NH3与硫酸反应生成(NH4)2SO4 , 铵根离子部分水解使溶液呈酸性,故溶液中的离子浓度关系为:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣),所以答案是:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣);(4)根据热化学反应方程式可知,4 mol SO2与2 mol O2完全反应放出的热量为:196 kJ×2=392 kJ,实际放出的热量为345 kJ,故SO2的转化率为:345 kJ/392 kJ=0.88,故选:D.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案