题目内容
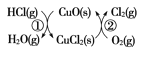
【题目】无水CuCl2为棕黄色固体,用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂等。实验室用如图所示装置制取CuCl2。(夹持装置省略)
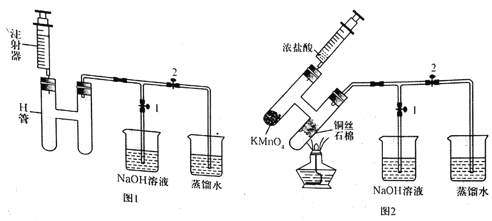
步骤1:制备时,首先按照图1所示连接实验装置。打开两处的止水夹,检验装置的气密性。
步骤2:用镊子向H管一端装入少量石棉,将其置于H管连通管以下部分且靠近连通管约![]() 处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
步骤3:关闭止水夹2,打开止水夹1,将H管如图2所示倾斜放置,点燃酒精灯,加热铜丝直至其呈红热状态。立即将浓盐酸注入H管使其与KMnO4发生反应(注意调整H管倾斜度以利于浓盐酸的加入),观察到有黄绿色气体通过连通管部分进入H管另一端,继而与热铜丝燃烧得到产物。
待反应结束后,等待一段时间再打开止水夹2,关闭止水夹1,拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。最后进行尾气的处理操作。请回答以下有关问题。
(1)检验图1所示装置气密性时的操作方法是______。反应过程中将H管倾斜放置的目的是_________(写出一条即可)。
(2)浓盐酸与KMnO4反应的化学方程式为______。热铜丝燃烧得到产物时,铜丝上方的H管中观察到的现象是_____。反应结束后,“等待一段时间”再进行后续操作的原因是______。
(3)实验观察到蒸馏水慢慢地吸入H管中时,H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。已知在溶液中[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈黄色。请用方程式表示溶液颜色变化的化学平衡体系:___。
(4)H管中铜丝不直接放置在右管底部的优点是___(写出两条即可)。
【答案】慢慢向上拉动注射器 便于用酒精灯加热(或有利于氯气与铜丝的接触等) 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 有棕黄色的烟产生 防止蒸馏水使热的H管炸裂 [CuCl4]2-+4H2O![]() [Cu(H2O)4]2++4Cl- 有利于氯气与铜丝接触②有利于观察溶液的形成过程③防止(或减少)反应过程中H管炸裂等
[Cu(H2O)4]2++4Cl- 有利于氯气与铜丝接触②有利于观察溶液的形成过程③防止(或减少)反应过程中H管炸裂等
【解析】
(1)根据压强对气体体积的影响分析;Cu与Cl2反应在加热条件下进行;
(2)浓盐酸具有还原性,KMnO4具有氧化性,二者混合发生氧化还原反应,产生KCl、MnCl2、Cl2、H2O,据此书写反应的化学方程式,结合CuCl2是棕黄色固体分析实验现象;玻璃导热性差,放置一段时间,H管温度降低,进入水,就可以避免H管炸裂;
(3)根据不同微粒的颜色的不同,结合平衡移动分析判断;
(4)从反应物接触面积大小、观察溶液颜色变化、实验安全等角度分析判断。
(1)检查装置气密性的方法是慢慢向上拉动注射器,使装置中气体压强减小,外界大气压大于装置内气体压强,水、NaOH溶液会沿导气管进入装置,形成一段稳定的水柱,从而证明装置气密性良好;
KMnO4与浓盐酸混合反应产生Cl2,Cl2与Cu在加热时反应产生CuCl2,Cu丝放在石棉绒上,将H管倾斜,就可以增大H管中Cu的受热面积,便于用酒精灯加热(或有利于氯气与铜丝的接触等);
(2)浓盐酸具有还原性,KMnO4具有氧化性,二者混合发生氧化还原反应,产生KCl、MnCl2、Cl2、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;Cu与Cl2加热反应产生CuCl2,使H管上部空间产生棕黄色的烟;该反应在加热条件下进行,反应放出热量,使H管内气体温度很高,反应结束后,“等待一段时间”待容器冷却后再拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。就可防止蒸馏水使热的H管炸裂;
(3)H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。这是由于在溶液中[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,在刚开始时溶液中[CuCl4]2-浓度较大,溶液显黄色,随着水的加入,溶液中水含量增多,发生反应:[CuCl4]2-+4H2O![]() [Cu(H2O)4]2++4Cl-,使[CuCl4]2-浓度减小,而[Cu(H2O)4]2+浓度逐渐增大,因此溶液颜色从黄绿色到绿色再到蓝绿色的变化过程;
[Cu(H2O)4]2++4Cl-,使[CuCl4]2-浓度减小,而[Cu(H2O)4]2+浓度逐渐增大,因此溶液颜色从黄绿色到绿色再到蓝绿色的变化过程;
(4)在进行该实验时,H管中铜丝不直接放置在右管底部而是放在石棉绒上,可以使H管中Cu丝底部有一定的空间,就有利于氯气与铜丝接触,使反应速率加快;同时可防止(或减少)反应过程中反应放出热,由于Cu丝直接接触容器导致H管炸裂;也有利于观察溶液的形成过程及溶液的颜色变化等。

 阅读快车系列答案
阅读快车系列答案