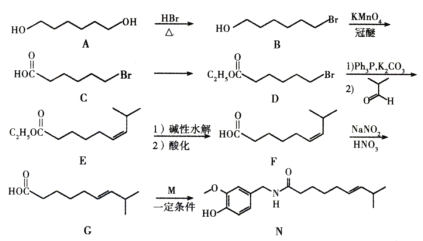
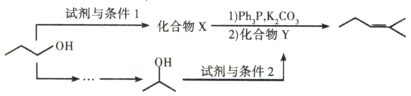
题目内容
【题目】用KI溶液和FeCl3溶液进行如下实验。下列说法中错误的是 ( )

A.实验i发生的反应为:2Fe3++2I-2Fe2++I2
B.黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子
C.实验ⅲ水溶液中c(Fe2+)小于ⅰ中c(Fe2+)
D.若向实验ⅲ所得液体中滴加![]() 溶液,水层红色比实验ⅱ浅
溶液,水层红色比实验ⅱ浅
【答案】C
【解析】
KI溶液中加入少量氯化铁溶液,发生氧化还原反应,2Fe3++2I- =I2+2Fe2+,溶液分成二等份,一份溶液中滴加KSCN溶液,溶液变红色,证明含铁离子,另一份溶液中滴加1mLCCl4溶液,碘单质溶于四氯化碳,下层为紫红色的碘的四氯化碳溶液,据此分析解答。
A.KI溶液中I-具有还原性,FeCl3溶液中Fe3+具有氧化性,二者发生氧化还原反应,滴加的氯化铁是少量的,反应后的溶液中滴加KSCN溶液,溶液变红色,证明含铁离子,说明铁离子反应不完全,发生的反应是可逆的,即2Fe3++2I-2Fe2++I2,故A正确;
B.氯化铁(少量)和碘化钾之间的反应,产物是氯化亚铁、氯化钾,碘单质,并且碘化钾剩余,反应是可逆的,还存在少量的氯化铁,即黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子,故B正确;
C.实验iii中生成的I2萃取到CCl4层,从溶液中分离出产物I2,使反应2Fe3++2I-2Fe2++I2正向移动,使c(Fe2+)大于i中c(Fe2+),故C错误;
D.实验iii是向所得液体中滴加CCl4,萃取了碘单质,反应2Fe3++2I-2Fe2++I2正向移动,铁离子浓度减小,所得液体中滴加KSCN溶液,水层红色变浅,故D正确;
故选C。

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目