题目内容
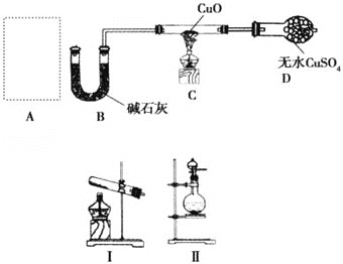
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。其实验操作为预先使棉花团浸透乙醇,并按照图示安装好装置;在铜丝的中间部分加热,片刻后开始(间歇性)鼓入空气,即可观察到明显的实验现象。

请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为________________________________。
(2)从A管中可观察到____________的实验现象。从中可认识到在该实验过程中,催化剂参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______________________。
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?__________,原受热部分的铜丝有什么现象?____________,产生这种现象是因为_________________________。
【答案】 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变亮 温度 能 仍可看到原受热部分的铜丝交替出现变黑、变亮的现象 因为醇的催化氧化反应是放热反应
2CH3CHO+2H2O 受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变亮 温度 能 仍可看到原受热部分的铜丝交替出现变黑、变亮的现象 因为醇的催化氧化反应是放热反应
【解析】(1)被加热的铜丝处,乙醇被氧化生成乙醛和水;(2)加热时,Cu被氧化生成CuO,然后CuO氧化乙醇生成乙醛、Cu和水,重复发生上述反应,且该反应需要在一定温度下进行;(3)撤掉酒精灯,反应仍进行,与反应放热有关。
(1)被加热的铜丝处,乙醇被氧化生成乙醛和水,该反应为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(2)加热时,Cu被氧化生成CuO,然后CuO氧化乙醇生成乙醛、Cu和水,重复发生上述反应,则可观察到A处受热部分的铜丝随间歇性地鼓人空气而交替出现变黑变亮,且该反应需要在一定温度下进行,则认识到催化剂起催化作用时需要一定的温度;(3)撤掉酒精灯,反应仍进行,是因醇的催化氧化反应是放热反应,温度较高,原受热的铜丝处仍可看到原受热部分的铜丝交替出现变黑一变亮的现象,答:反应仍可继续进行;仍可看到原受热部分的铜丝交替出现变黑一变亮的现象;因为醇的催化氧化反应是放热反应。
2CH3CHO+2H2O;(2)加热时,Cu被氧化生成CuO,然后CuO氧化乙醇生成乙醛、Cu和水,重复发生上述反应,则可观察到A处受热部分的铜丝随间歇性地鼓人空气而交替出现变黑变亮,且该反应需要在一定温度下进行,则认识到催化剂起催化作用时需要一定的温度;(3)撤掉酒精灯,反应仍进行,是因醇的催化氧化反应是放热反应,温度较高,原受热的铜丝处仍可看到原受热部分的铜丝交替出现变黑一变亮的现象,答:反应仍可继续进行;仍可看到原受热部分的铜丝交替出现变黑一变亮的现象;因为醇的催化氧化反应是放热反应。

【题目】某学生用0.2000molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号) , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) .
(2)判断滴定终点的现象是: .
(3)如图是某次滴定时的滴定管中的液面,其读数为mL. ![]()
(4)根据下列数据:请计算待测盐酸溶液的浓度:mol/L.
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
【题目】太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下:

(1)下列说法中,正确的是______( 填字母序号)。
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A 的电极反应式为___________;充电时电极B 做______极。
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH 范围不同时,钒的存在形式如下表所示:
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+,VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为_______、_______;所得滤液1中,铝元素的存在形式为__________。
②向碱性的滤液1( V的化合价为+4 )中加入H2O2的作用是________(用离子方程式表示)。