题目内容
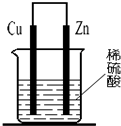 关于如图所示装置,下列叙述正确的是( )
关于如图所示装置,下列叙述正确的是( )分析:该原电池中,锌易失电子作负极,铜作正极,
A.电子从负极沿导线流向正极;
B.根据溶液中离子变化及锌离子颜色判断;
C.正极上氢离子得电子发生还原反应;
D.失电子的物质发生氧化反应.
A.电子从负极沿导线流向正极;
B.根据溶液中离子变化及锌离子颜色判断;
C.正极上氢离子得电子发生还原反应;
D.失电子的物质发生氧化反应.
解答:解:A.该原电池中,锌作负极,铜作正极,电子从负极沿导线流向正极,正极上氢离子得电子生成氢气,所以电子流入大量产生气泡的一极,故A错误;
B.该原电池中,负极上锌失电子生成锌离子进入溶液,锌离子无色,正极上氢离子得电子生成氢气,溶液中没有铜离子产生,所以溶液不变蓝色,故B错误;
C.正极上氢离子得电子生成氢气,所以溶液中阳离子浓度逐渐减小,故C正确;
D.锌失电子生成锌离子进入溶液,导致锌逐渐减少,锌失电子发生氧化反应,故D错误;
故选C.
B.该原电池中,负极上锌失电子生成锌离子进入溶液,锌离子无色,正极上氢离子得电子生成氢气,溶液中没有铜离子产生,所以溶液不变蓝色,故B错误;
C.正极上氢离子得电子生成氢气,所以溶液中阳离子浓度逐渐减小,故C正确;
D.锌失电子生成锌离子进入溶液,导致锌逐渐减少,锌失电子发生氧化反应,故D错误;
故选C.
点评:本题考查了原电池原理,明确正负极上得失电子、发生的反应即可解答,难度中等.

练习册系列答案
相关题目
 某课外活动小组做了如下关于钾的探究实验.
某课外活动小组做了如下关于钾的探究实验. 关于如图所示装置的判断,叙述正确的是( )
关于如图所示装置的判断,叙述正确的是( )

