题目内容
(8分)现有pH都等于1的盐酸和硫酸,及溶液的浓度都等于0.1 mol·L-1的NaOH和Ba(OH)2溶液,四种溶液以等体积混合时,求所得溶液的pH。
12.4
假设溶液的体积均为1 L,混合后溶液的总体积为4 L。
n总(H+)=n盐酸(H+)+n硫酸(H+)="0.1" mol·L-1×1 L+0.1 mol·L-1×1 L="0.2" mol
n总(OH-)=nNaOH(OH-)+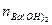 (OH-)="0.1" mol·L-1×1 L+2×0.1 mol·L-1×1 L="0.3" mol
(OH-)="0.1" mol·L-1×1 L+2×0.1 mol·L-1×1 L="0.3" mol
混合后,n混(OH-)="0.3" mol-0.2 mol="0.1" mol
所以c(OH-)="0.1" mol/4 L="0.025" mol·L-1
c(H+)=KW/0.025 mol·L-1=4×10-13 mol·L-1
pH=13-2lg2=12.4。
n总(H+)=n盐酸(H+)+n硫酸(H+)="0.1" mol·L-1×1 L+0.1 mol·L-1×1 L="0.2" mol
n总(OH-)=nNaOH(OH-)+
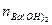 (OH-)="0.1" mol·L-1×1 L+2×0.1 mol·L-1×1 L="0.3" mol
(OH-)="0.1" mol·L-1×1 L+2×0.1 mol·L-1×1 L="0.3" mol混合后,n混(OH-)="0.3" mol-0.2 mol="0.1" mol
所以c(OH-)="0.1" mol/4 L="0.025" mol·L-1
c(H+)=KW/0.025 mol·L-1=4×10-13 mol·L-1
pH=13-2lg2=12.4。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目

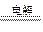 4H++2Cu+O2↑
4H++2Cu+O2↑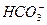 +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O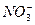 ====3Fe3++2NO↑+4H2O
====3Fe3++2NO↑+4H2O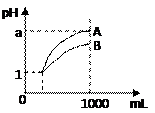
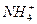 )=2.0×10-6 mol·L-1、C(Cl-)=3.5×10-6 mol·L-1、C(
)=2.0×10-6 mol·L-1、C(Cl-)=3.5×10-6 mol·L-1、C(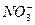 )=4.5×10-6 mol·L-1、C(
)=4.5×10-6 mol·L-1、C(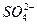 )=5.0×10-6 mol·L-1,则此雨水的pH约为( )
)=5.0×10-6 mol·L-1,则此雨水的pH约为( )