题目内容
17.写出下列氧化还原反应的化学方程式,并指出氧化剂、还原剂,标明电子转移的情况.(1)氯酸钾在二氧化锰的催化下加热分解;
(2)铝片与硝酸汞溶液反应;
(3)氧化铁在高温下与一氧化碳反应.
分析 (1)氯酸钾在二氧化锰的催化下加热分解生成氯酸钾和氧气,氧元素的化合价升高,氯元素的化合价降低;
(2)铝片与硝酸汞溶液反应生成硝酸铝和汞,铝元素的化合价升高,汞元素的化合价降低;
(3)氧化铁在高温下与一氧化碳反应生成铁和二氧化碳,碳元素的化合价升高,铁元素的化合价降低.
解答 解:(1)氯酸钾在二氧化锰的催化下加热分解生成氯化钾和氧气,方程式为:2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑,反应中Cl元素化合价从+5价变化为-1价,化合价降低得到电子,所以KClO3做氧化剂,O元素的化合价从-2价变化为0价,元素化合价升高失电子,所以KClO3做还原剂,转移12e-,
答:反应为2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑,氧化剂KClO3,还原剂 KClO3,转移12e-;
(2)铝片与硝酸汞溶液反应生成硝酸铝和汞,方程式为:2Al+3Hg(N O3)2=2A l(NO3)2+3Hg,反应中Hg元素化合价从+2价变化为0价,化合价降低得到电子,所以Hg(N O3)2做氧化剂,铝元素的化合价从0价变化为+3价,元素化合价升高失电子,所以Al做还原剂,转移6e-,
答:反应为2Al+3Hg(N O3)2=2A l(NO3)2+3Hg,氧化剂为Hg(N O3)2,还原剂为Al,转移6e-;
(3)氧化铁在高温下与一氧化碳反应生成铁和二氧化碳,方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应中铁元素化合价从+3价变化为0价,化合价降低得到电子,所以Fe2O3做氧化剂,碳元素的化合价从+2价变化为+4价,元素化合价升高失电子,所以CO做还原剂,转移6e-,
答:反应为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,氧化剂为Fe2O3做,还原剂为CO,转移6e-.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应及元素的化合价变化为解答的关键,侧重基本概念及化学方程式书写的考查,题目难度不大.

| A. | 某溶液中加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,则该溶液一定含有SO42- | |
| B. | FeCl3稀溶液与Fe(OH)3胶体本质区别是分散质粒子的大小 | |
| C. | Fe(OH)3胶体可以产生电泳现象,由此可知Fe(OH)3胶体溶液带电 | |
| D. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
①乙酸乙酯的结构简式:CH3CH2COOCH2CH3
②CO2分子的结构式:O=C=O
③乙烯的实验式:C2H4
④S原子的结构示意图:
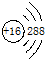
⑤葡萄糖结构简式:C6H12O6
⑥CH4Si的结构式
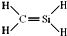
| A. | 只有②⑥ | B. | 只有③④ | C. | 只有②③⑥ | D. | 只有①②⑥ |
| A. | 电能是二级能源 | B. | 水力是二级能源 | ||
| C. | 天然气是二级能源 | D. | 焦炉气是一级能源 |
| A. | 面粉中添加增白剂 | B. | 奶粉中添加三聚氰胺 | ||
| C. | 用乙烯进行水果催熟 | D. | 饮料中添加塑化剂 |
| A. | 分散质直径介于1~100 nm之间的分散系称为胶体 | |
| B. | 胶体、溶液、浊液都是分散系 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 胶体粒子很小,可以透过半透膜 |
| A. | 明矾净水效果很好,长期饮用没有任何危害 | |
| B. | 纯净水干净卫生,提倡长期饮用纯净水 | |
| C. | 大量城市垃圾会占用土地,垃圾的无害化处理就是焚烧 | |
| D. | 豪华装修后的房间可能会有甲醛、苯等污染空气 |
| A. | MnO4-→Mn2+ | B. | HCO3-→CO2 | C. | Fe→Fe3+ | D. | HCl→Cl2 |